=http://www.medicalistes.org/spip/article154.html
Archives mensuelles : octobre 2005
Complications Digestives Après Transplantation
- Auteurs:F. BLOCH ET D. FARGE
- Ouvrage: Traité de Médecine (3ème édition), éd. Flammarion
- Date de publication: septembre 1996
Nous sommes conscients que cet article est relativement ancien; toutefois, il renferme des renseignements qui vous seront sans doute utiles; aussi l’avons-nous laissé en ligne. Par ailleurs, si vous disposiez d’articles plus récents sur le même sujet, n’hésitez pas à nous en faire part afin de demander leur autorisation à leurs auteurs pour une publication en ligne sur ce site
- Complications sophagiennes
- Complications gastro-duodénales
- Complications hépatiques
- Complications bilio-pancréatiques
- Complications iléo-coliques
- Cancers digestifs
La fréquence des complications digestives après transplantation d’organe et greffe de moelle osseuse varie dans les différentes publications de l à 23 p. l00 selon les critères d’inclusion, les périodes d’étude et le traitement immunosuppresseur. Elles peuvent toucher tous les organes de l’appareil digestif et sont responsables d’une morbidité et d’une mortalité non négligeables. Certaines sont liées au terrain, d’autres aux traitements immunosuppresseurs, d’autres enfin à des pathologies de rencontre. Leur gravité potentielle incite à rechercher les éléments susceptibles de les favoriser au cours d’un bilan complet avant la greffe qui comprendra : une fibroscopie haute à la recherche d’une oesophagite peptique ou d’une maladie ulcéreuse, une coloscopie recherchant une diverticulose ou une pathologie précancéreuse et une échographie abdominale. Seront également recherchées des anomalies du bilan biologique hépatique et les marqueurs sérologiques des hépatites virales A, B, C et éventuellement D.
COMPLICATIONS OESOPHAGIENNES
Les atteintes oesophagiennes sont principalement d’origine infectieuse, favorisées par l’immunodépression. Il s’agit d’infections fungiques ou virales à cytomégalovirus (CMV) ou herpès virus.
CANDIDOSES
Les candidoses oesophagiennes, isolées ou s’inscrivant dans le cadre d’une atteinte systémique, sont fréquentes (l0 à 20 p. l00). Elles sont responsables de douleurs épigastriques et rétrosternales, d’une dysphagie, de vomissements, plus rarement d’hémorragies digestives. L’endoscopie montre une paroi oesophagienne tapissée d’un enduit blanchâtre adhérent, punctiforme ou en plages plus larges, reposant sur une muqueuse rouge et parfois friable. Les biopsies avec coloration par le PAS confirment le diagnostic. En cas d’atteinte oeophagienne isolée, le traitement par fluconazole per os est en règle efficace. La fréquence des candidoses digestives justifie un traitement préventif systématique par amphotéricine B per os non absorbée.
OESOPHAGITES VIRALES
Les oesophagites virales sont liées au CMV ou au virus de l’Herpès simplex. Elles sont le plus souvent associées à des atteintes gastro-intestinales diffuses, et peuvent précéder l’atteinte systémique. Elles sont responsables de douleurs rétrosternales ou épigastriques, d’une dysphagie et/ou d’hémorragies. L’endoscopie haute permet un diagnos tic rapide. Les lésions macroscopiques soni variables : aspects polypoïdes, ulcérations aphtoïdes, ulcérations planes plus larges sur une muqueuse congestive ou ulcérations arrondies, à bords surélevés, de petite taille, d’aspect bulleux, évocatrices d’une infection herpétique. Les biopsies mettent en évidence la présence d’inclusions virales intranucléaires dans 25 à 80 p. l00 des cas, avant les résultats des cultures virales. Les oesophagites herpétiques nécessitent un traitement par l’aciclovir pendant l0jours au minimum. Les oesophagites à CMV sont traitées par le ganciclovir pendant une durée minimale de 2l jours.
COMPLICATIONS GASTRO-DUODENALES
ULCERES GASTRO-DUODENAUX
Les ulcères surviennent dans 50 p. l00 des cas dans les 3 mois suivant la transplantation et sont souvent révélés par une hémorragie. Les épisodes de rejet, une infection, la survenue d’une hépatite constituent des facteurs favorisants. Le diagnostic est endoscopique. Des biopsies systématiques sont nécessaires pour détecter une infection latente à CMV. Le traitement repose sur les anti-H2 et les inhibiteurs de la pompe à protons. Un traitement chirurgical peut être nécessaire. Leur prévention justifie l’administration systématique d’antisécrétoires gastriques dans la période postopératoire, qui peuvent cependant modifier l’absorption des immunosuppresseurs, notamment de la ciclosporine.
INFECTIONS A CMV
Les infections gastro-duodénales à CMV sont fréquentes, responsables de douleurs épigastriques ou abdominales et d’hémor ragies digestives parfois graves. Une diarrhée associée signe en général l’existence d’une atteinte intestinale concomitante. L’endoscopie permet le diagnostic; les lésions observées sont polymorphes : aspects de gastrite congestive ou de duodénite, gros plis cérébriformes, pseudopolypes, lésions nodulaires, ulcérations gastriques et/ou duodénales, le plus souvent multiples parfois varioliformes, de grande taille, souvent hémorragiques. Les biopsies apportent un diagnostic rapide. Le traitement par ganciclovir pendant une durée minimale de 2l jours est habituellement efficace, mais quelques cas d’hémorragies digestives fatales ont été rapportés. La gravité des infections gastro-intestinales à CMV justifie chez les transplantés leur recherche endo scopique dès l’apparition de symptômes digestifs, autorisant une mise en oeuvre précoce du traitement.
COMPLICATIONS HEPATIQUES
Les complications hépatiques sont fréquentes après transplantation et sont dominées par les hépatites chroniques d’origine virale et leur récidive sur le greffon après transplantation hépatique.
HEPATITES AIGUES
Les hépatites aiguës liées au virus B (HBV) sont devenues rares chez le transplanté. L’apparition d’un ictère ou d’anomalies biologiques hépatiques chez un sujet porteur chronique de l’Ag HBs doit faire suspecter une réactivation de la multiplication virale induite par le traitement immunosuppresseur ou une surinfection virale, en particulier par le virus D. Une prévention rigoureuse repose sur la vaccination précoce, surtout chez les insuffisants rénaux. L’utilisation du vaccin recombinant, parfois de doubles doses, semble en améliorer l’efficacité.
L’infection par le virus de l’hépatite C, l’HCV, est rarement responsable d’une hépatite aiguë clinique. L’apparition d’anticorps anti-HCV est tardive et inconstante. En revanche, la recherche d’ARN du virus C par PCR est fréquemment positive après transplantation.
Les hépatites aiguës liées aux virus du groupe herpès sont fréquentes. Le CMV est le plus souvent incriminé. Sa responsabilité est affirmée par la positivité de la virémie, l’ascension des taux d’anticorps anti-CMV de type IgM, enfin la présence de lésions hépatiques granulomateuses et d’inclusions cytomégaliques sur la ponction-biopsie hépatique lorsqu’elle est effectuée. Le pronostic des hépatites à CMV est le plus souvent bénin. Le virus d’Epstein-Barr, le virus Herpès de type I ou II sont plus rarement responsables d’hépatites aiguës.
HEPATITES CHRONIQUES VIRALES
La fréquence des atteintes hépatiques liées au HBV a été estimée chez les transplantés rénaux à l4 à 33 p. l00. Les critères cliniques et biologiques habituels font souvent défaut. Après transplantation, l’augmentation des marqueurs de réplication virale chez les malades Ag HBs positifs et une apparition de ceux-ci chez 20 p. l00 environ des malades Ag HBs négatifs est fréquente. L’insuffisance hépatique est la quatrième cause de décès (14p.100) de ces malades. Plusieurs études ont montré chez les malades Ag HBs positifs une augmentation du risque de mortalité par atteinte hépatique après transplantation par rapport aux hémodialysés. Après transplantation hépatique, la récurrence de l’infection par l’HBV est de 75 à 90 p. l00. L’infection du greffon évolue soit vers la chronicité, conduisant parfois rapidement à la cirrhose, soit vers une insuffisance hépatique aiguë. La seule thérapeutique ayant fait la preuve de son efficacité est l’immunoprophylaxie continue par les immunoglobulines polyclonales anti-HBs.
Les infections par l’HCV après transplantation apparaissent plus fréquentes encore : 9 à 35 p. l00 après transplantation hépatique, l2 p. l00 après greffe rénale. Elles constituent la majorité des hépatites non A-non B posttransplantation. Leur diagnostic doit faire appel aux techniques sérologiques les plus sensibles et surtout à la détection d’ARN viral par PCR, car les transaminases restent souvent normales et les sérologies fréquemment négatives. Chez les patients infectés par l’HCV, la récidive après greffe hépatique est quasi constante. La réplication de l’HCV est accentuée après transplantation. Les hépatites aiguës ou fulminantes sont exceptionnelles, mais l’hépatite chronique active d’évolution rapide est fréquente. Le traitement par interféron est peu efficace et contre-indiqué chez les transplantés car il favorise le rejet. Le pronostic à long terme est encore mal connu.
AUTRES ATTEINTES HEPATIQUES
La péliose, décrite chez les transplantés rénaux, est la seule lésion qui puisse être directement attribuée à la transplantation. Sa fréquence est de 2,4 à 6,5 p. l00. La maladie veinoocclusive est une complication majeure après greffe de moelle avec une incidence variable selon la nature de la pathologie initiale et du conditionnement. L’hyperplasie nodulaire régénérative est plus rare, responsable d’une cholestase et/ou d’une hypertension portale d’évolution souvent sévère. Les atteintes hépatiques d’origine médicamenteuse sont fréquentes.
COMPLICATIONS BILIO-PANCREATIQUES
PANCREATITES AIGUES
Après transplantation rénale, une pancréatite aiguë survient chez 0,5 p. l00 des patients. Sa fréquence est plus élevée après greffe cardiaque, variant entre 2,8 et l7 p. l00. De nombreux facteurs peuvent être impliqués dans le déclenchement de ces pancréatites, notamment une baisse du débit de perfusion, une vasoconstriction splanchnique ou des microembolies pancréatiques. Cela ne rend cependant pas compte des atteintes tardives. En dehors d’une origine biliaire rare, force est d’envisager le role des agents immunosuppresseurs. Le diagnostic n’est pas toujours facile et, devant tout syndrome abdominal mal expliqué, il faut évoquer ce diagnostic et rechercher une élévation de l’amylasémie et de la lipasémie, demander une échographie et surtout un examen tomodensitométrique du pancréas, qui apporte des arguments diagnostiques. 1l s’agit d’une complication sévère puisque la mortalité rapportée est de 40 p. l00, mais chez les survivants la restitution du pancréas s’effectue ad integrum. Au décours de l’épisode aigu, il convient d’éliminer de facon formelle toute atteinte lithiasique qui impliquerait une cholécystectomie préventive des récidives.
COMPLICATIONS BILIAIRES
Les complications biliaires représentent la cause la plus fréquente de laparotomie chez les transplantés. La survenue d’une cholécystite dans les jours ou semaines qui suivent la transplantation peut poser de difficiles problèmes diagnostiques, lorsque les signes abdominaux sont abâtardis par la corticothérapie. Le diagnostic repose sur l’échographie, au besoin répétée, à la recherche d’une grosse vésicule à paroi épaissie, avec ou sans lithiase. Le traitement est chirurgical après large couverture antibiotique. À plus long terme, l’apparition d’une lithiase vésiculaire est une éventualité souvent rencontrée dans le suivi de tout patient greffé. La cause d’apparition de ces lithiases est mal élucidée. Leur survenue impose, dans tous les cas, la cholécystectomie pour mettre ces patients à l’abri de tout épisode infectieux aigu.
COMPLICATIONS ILEO-COLIQUES
L’incidence des complications intestinales est en moyenne de 2,2 p. l00 après transplantation.
ATTEINTES DU GRELE
Au niveau de l’intestin grêle, les complications sont le plus souvent dues aux interventions préalables et se présentent sous forme d’occlusions sur brides. La survenue de Iymphomes du grêle, souvent révélés par une perforation, est fréquente.
APPENDICITES
Les appendicites sont rares. Lorsqu’elles surviennent, elles se compliquent souvent d’abcès et de perforation, favorisés par le traitement immunosuppresseur. Seul l’examen clinique permet d’en faire le diagnostic, et il faut savoir poser l’indication opératoire lorsque un doute persiste.
COMPLICATIONS COLIQUES
Les complications coliques sont responsables d’une lourde mortalité, oscillant entre 50 et 72 p. l00. Les perforations du côlon sont le plus souvent liées à une maladie diverticulaire. Ce risque doit inciter à lutter contre la constipation chronique et à proposer une sigmoïdectomie à froid chez les patients ayant présenté des épisodes de diverticulite. D’autres causes de perforation colique sont possibles : perforation diastatique secondaire à une colectasie ou à une stase stercorale, perforation au stade ultime d’une colite ischémique, enfin perforation secondaire à certains traitements immunosuppresseurs, ou en rapport avec une infection virale, notamment à CMV. Il ne faut pas hésiter à consulter des chirurgiens viscéraux dès qu’une complication abdominale est suspectée pour proposer une laparotomie précoce lorsque le traitement médical échoue. Cette attitude a abaissé considérablement la mortalité de ces complications, autrefois proche de 100 p. l00.
Plusieurs dizaines de cas de colite ischémique ont été rapportés, le plus souvent dans les jours ou les quelques semaines suivant la transplantation. Elle est favorisée par la maladie athéromateuse, par des épisodes d’hypotension artérielle ou par la distension colique postopératoire. Le tableau clinique associe douleur abdominale, distension, diarrhée ou rectorragies. Après élimination radiologique d’une perforation, le diagnostic est assuré par la coloscopie. Rares sont les cas où une nécrose colique impose d’emblée un geste chirurgical. Le plus souvent, une surveillance clinique attentive et la répétition des endoscopies permet de juger de l’évolutivité des lésions et de poser l’indication éventuelle d’un acte chirurgical. La mortalité reste élevée.
Les colites pseudo-membraneuses sont diagnostiquées par coproculture et coloscopie et traitées par antibiothérapie (vancomycine ou métronidazole).
Des colites uIcéreuses certaines aspécifiques, d’autres liées à une tuberculose ou une infection virale peuvent entramer des saignements abondants. La fréquence des infections coliques à CMV doit conduire à effectuer des biopsies coliques étagées systématiques lors de toute coloscopie.
De nombreux cas de pseudo-obstrucfion colique (syndrome d’Ogilvie) ont été décrits après transplantation rénale et cardiaque. Trois fois sur quatre, tout rentre dans l’ordre avec des petits moyens. Sinon, l’endoscopie permet une décompression colique, mettant ainsi à l’abri de l’ischémie caecale. Le tableau clinique réalisé par la pneumatose colique se rapproche du précédent. Mais sur les clichés d’abdomen sans préparation, des clartés gazeuses infiltrent les parois digestives, diffusent au sein des mésos et peuvent même parfois s’accompagner d’un pneumopéritoine. La pneumatose est souvent liée à une infection à CMV, et justifie la prescription de thérapeutiques antivirales. Aucun geste chirurgical n’est nécessaire, et il faut savoir éviter une laparotomie inutile, même en cas de pneumopéritoine.
CANCERS DIGESTIFS
Le risque de survenue d’un cancer digestif après transplantation d’organe est apprécié entre 4 et l0 p. l00. Le risque de lymphome est 30 à l00 fois plus important après transplantation d’organe que dans la population générale, avec une localisation digestive présente une fois sur dix.
Cancers après Transplantation d’Organe et Greffe de Moëlle Osseuse
- Auteurs:D. FARGE ET J.-M. EXTRA
- Ouvrage: Traité de Médecine (3ème édition), éd. Flammarion
- Date de publication: septembre 1996
Nous sommes conscients que cet article est relativement ancien; toutefois, il renferme des renseignements qui vous seront sans doute utiles; aussi l’avons-nous laissé en ligne. Par ailleurs, si vous disposiez d’articles plus récents sur le même sujet, n’hésitez pas à nous en faire part afin de demander leur autorisation à leurs auteurs pour une publication en ligne sur ce site
Le risque de développer un cancer après greffe est de 5 à 6 p. l00, 100 fois plus élevé que dans la population générale. Avant greffe, certains candidats ont eux-mêmes un risque accru de cancer, tel l’insuffisant rénal chronique chez qui la fréquence des tumeurs malignes est 7 fois plus élevée que dans la population générale; de plus, l’effet leucémogène des alkylants (cyclophosphamide) et cancérigène de l’irradiation corporelle totale est bien démontré. Après greffe, l’immunosuppression augmente le risque lié à l’oncogenèse virale, avec des différences selon les substances utilisées; plus accessoirement, la surveillance médicale intensive concourt à l’augmentation apparente de l’incidence des cancers.
Chez les transplantés d’organe, certaines tumeurs malignes se développent préférentiellement. Par rapport à la population générale, le risque relatif de lymphome est multiplié par 30 à 50, de cancer cutané par 4 à 20, de cancer du col utérin par l4, de cancer ano-génital par l00, de sarcome de Kaposi par 400, de cancer des voies urinaires par 6, de mélanome par 5 à l0, de leucémies par 4. Après greffe de moelle, le risque de tumeurs malignes secondaires à l0 ans est de l0 p. l00 : il s’agit essentiellement de lymphomes non hodgkiniens, de leucémies, de glioblastomes et de tumeurs solides variées. Si ces chiffres sont impressionnants, leur nombre absolu après greffe reste faible, car il s’agit de tumeurs peu fréquentes dans la population générale, hormis les cancers cutanés, d’excellent pronostic. Bien que réel, le risque tumoral n’intervient donc qu’en faible proportion dans la mortalité des patients.
DONNEES EPIDEMIOLOGIQUES
Sources d’information
L’épidémiologie des tumeurs malignes après transplantation d’organe est plus ou moins bien connue selon les pays: aux ÉtatsUnis, les registres de Denver et de Cincinnati colligent les données depuis l968, et en Europe le registre collaboratif d’Opeltz centralise les informations. Après greffe de moelle osseuse, un registre européen des cancers secondaires collige toutes les données.
Cancers préexistants
Le bilan prégreffe écarte les candidats porteurs d’une tumeur maligne. La transplantation d’un organe issu d’un donneur porteur d’un cancer est contre-indiquée, sauf en cas de carcinome cutané de bas grade ou du système nerveux central.
Cancers de novo
La majorité des tumeurs malignes après greffe apparaît de novo. Elles sont parfois multiples (6,4p.l00 des cas du registre de Cincinnati). L’incidence et la répartition des types tumoraux varient fortement selon les pays, l’immunosuppression utilisée et la durée du suivi, plus faiblement selon la nature de l’organe transplanté. Sous immunosuppression conventionnelle, I’incidence des tumeurs après transplantation d’organe variait de l,6 à 24 p. l00 selon les études. Aux posologies actuelles de ciclosporine, le risque global de cancer secondaire, de l,3p.l00, semble plus faible. Par contre, le délai d’apparition des tumeurs est plus court sous ciclosporine (26 mois en moyenne) que sous traitement conventionnel (68 mois) et l’utilisation plus récente des anticorps monoclonaux augmente le risque d’apparition des lymphomes.
DONNEES VIROLOGIQUES
La plupart des tumeurs observées chez les transplantés sont associées non fortuitement à des infections virales, et de manière assez spécifique selon le type de tumeur observée: virus d’Epstein-Barr pour les syndromes lymphoprolifératifs, Papillomavirus pour les cancers cutanés et anogénitaux, virus de l’hépatite B pour les hépatocarcinomes. Ces virus jouent un rôle dans la carcinogénèse observée, même si les mécanismes précis restent encore inconnus chez l’homme.
VIRUS D’EPSTEIN-BARR
Une forte association entre infection à EBV et lymphomes postgreffe est démontrée par les données sérologiques, la présence d’antigènes viraux et la mise en évidence du génome EBV dans les cellules tumorales. La séquence des événements intervenant dans le développement des lymphomes après transplantation peut être comparée à celle du lymphome de Burkitt africain, avec 2 étapes proposées pour la carcinogénèse: une phase initiale de prolifération polyclonale des lymphocytes B infectés par EBV de façon latente; puis une sélection clonale secondaire à des altérations génomiques spécifiques , représentées par une translocation réci – proque spécifique entre les gènes codant pour les immunoglobulines et le gène du proto-oncogène c-myc, entraînant sa dysrégulation et par un mécanisme encore inconnu à une prolifération. Les lymphomes post-greffe sont aussi de type B, mais non de type Burkitt. Dans ce cas, la phase de prolifération polyclonale est favorisée par l’immunosuppression des lymphocytes T. Par contre, le passage d’une prolifération polyclonale à une prolifération monoclonale, n’est pas lié à une altération de c-myc dans la plupart des cas. L’expression de certains antigènes (nuclear protein et latent membrane protein) est fortement augmentée dans ces lymphomes, alors qu’elle est inhibée dans les lymphomes de Burkitt. Ces antigènes viraux sont la cible de la réponse immunitaire T; leur présence dans les cellules tumorales est un indice de sensibilité à la destruction immunitaire, et donc au rôle thérapeutique possible de la diminution, voire de l’arrêt de l’immunosuppression T. La ciclosporine pourrait favoriser la prolifération des cellules B infectées par l’EBV en augmentant l’expression du gène de l’interleukine 6.
PAPILLOMAVIRUS HUMAINS (HPV)
Il existe plus de 60 types d’HPV impliqués dans des pathologies aussi variées que les verrues, les condylomes acuminés, l’épidermodysplasie verruciforme, les cancers cutanés, les dysplasies et cancers cervicaux et ano-génitaux. Après transplantation rénale, l’ADN viral des HPV 5 et 8 est retrouvé dans 60 p. l00 des cancers cutanés, l’ADN de HPV l6 dans 86 p. l00 des dysplasies et cancers du col utérin. Les données in vitro, principalement sur des lignées de cancers cervicaux, ont permis d’établir que 2 protéines codées par le génome viral (E6 et E7), interagissaient avec 2 protéines cellulaires majeures, codées par le gène p53 et le gène du rétinoblastome, tous deux de la famille des anti-oncogènes. Cette interaction entraîne l’inhibition de ces protéines et lève donc l’inhibition de la croissance et de la prolifération cellulaire. Cependant, d’autres facteurs interviennent dans cette carcinogénèse, comme le rayonnement ultraviolet pour les cancers cutanés, les infections herpétiques et le tabac pour les cancers du col utérin.
VIRUS DE L’HEPATITE B
Chez les transplantés rénaux porteurs de l’antigène HBs, l’évolution vers l’hépatite chronique active ou la cirrhose avec décès par hépatome est nettement plus fréquente que chez des témoins hémodialysés porteurs chroniques de l’HBV. Les mécanismes de l’hépatocarcinogenèse liée à l’HBV restent encore inconnus, de même que le potentiel des autres virus générateurs d’hépatite.
DONNEES CLINIQUES
SYNDROMES LYMPHOPROLIFERATIFS
Il s’agit dans l’immense majorité des cas de lymphomes non hodgkiniens de phénotype B, originaires du receveur et associés à l’EBV. Ces syndromes lymphoprolifératifs peuvent être classés en 3 types.
L’hyperplasie B diffuse polymorphe avec un tableau clinique ressemblant à celui d’une mononucléose, caractérisé par le polymorphisme cytologique, la polyclonalité, l’absence d’anomalie cytogénétique et de réarrangement des gènes des Ig (immunoglobulines).
Le lymphome B diffus polymorphe, caractérisé par le polymorphisme cytologique, la polyclonalité, mais avec présence d’un réarrangement des gènes d’Ig dans une population cellulaire minoritaire.
Le lymphome B monoclonal, caractérisé par un clone majoritaire ayant un réarrangement des gènes d’Ig et des anomalies cytogénétiques. Cytologiquement, ce lymphome est rarement monomorphe à grandes cellules, ou beaucoup plus souvent polymorphe avec un contingent de cellules plasmocytoïdes. Cliniquement, il existe des masses tumorales.
D’après les données du registre de Cincinnati, la présentation de ces lymphomes diffère selon l’immunosuppression: le délai moyen d’apparition est de 8,5 mois sous ciclosporine contre 4l mois sous traitement conventionnel; la fréquence des formes extraganglionnaires est de 59 p. l00 sous ciclosporine (proche de celle de la population générale) contre 78p.l00 sous traitement conventionnel. Les lymphomes du système nerveux central (2 p. l00 versus 42 p. l00) et les formes localisées (39 p.100 versus 54 p. l00) sont beaucoup moins fréquents sous ciclosporine que sous traitement conventionnel. Dans une étude récente chez 45140 transp1antés rénaux et 7630 transplantés cardiaques, 3l7 lymphomes ont été recensés, principalement durant la première année après transplantation. L’incidence des lymphomes durant cette première année est directement conditionnée par la lourdeur de l’immunosuppression, avec une fréquence plus élevée chez les transplantés cardiaques en Amérique du Nord (RR = 3) comparés aux transplantés cardiaques européens (RR = 2,l2), en cas d’utilisation de sérum antilymphocytaire ou d’OKT3 (RR = l,8) et lors de l’association ciclosporine-azathioprine (RR = l,47). Après la première année, le risque de lymphome est plus élevé chez les transplantés cardiaques (RR = 7,68) et chez les transplantés de plus de 50 ans (RR = l,87).
La fréquence des syndromes lymphoprolifératifs est analogue chez les greffés de moelle pour hémopathie maligne et pour aplasie, avec une apparition très précoce, en règle dans les 6 premiers mois postgreffe. Tous les intermédiaires entre hyperplasie B diffuse polymorphe et lymphome B monoclonal, le plus souvent associés à l’EBV, sont observés, mais d’autres tormes ont été décrites : lymphadénopathie angio- immunoblastique, Iymphome B lymphoblastique, lymphome T et maladie de Hodgkin.
CANCERS CUTANES
Les cancers de la peau et des lèvres sont les plus fréquents après transplantation d’organe (39 p. l00 dans le registre de Denver). Cette fréquence n’est pas augmentée chez les greffés de moelle osseuse soumis à une immunosuppression transitoire. Le cancer des lèvres survient chez 8p.l00 des transplantés rénaux, avec un délai moyen d’apparition de 5,3 ans (registre de Denver) et est associé une fois sur deux à un cancer cutané. Les cancers cutanés surviennent essentiellement dans les régions exposées au soleil, et leur risque cumulatif augmente avec le temps de survie du transplant, passant de l0 p. l00 après l0 ans à 40 p. l00 après 20 ans en zone de faible exposition solaire et de 3 p. l00 après l an à 44 p. l00 après 9 ans en zone de forte exposition solaire. Ces cancers surviennent en moyenne 7 à 9 ans après la transplantation et 20 à 30 ans plus tôt que chez des sujets non transplantés. Contrairement à la population générale, les carcinomes spinocellulaires sont plus fréquents que les basocellulaires. 1ls sont souvent multiples, de manière simultanée ou séquentielle, également pIus agressifs, avec 17p.100 de récidive locale et l2p.100 d’atteinte ganglionnaire dans une étude. En Austra1ie, 1’incidence des mélanomes est multipliée par 5 après transp1antation d’organe.
CANCERS ANO-GENITAUX ET CERVICAUX
Les cancers ano-génitaux sont des carcinomes malpighiens, rares dans la popu1ation générale comme après greffe de moelle osseuse. Leur incidence est multipliée par 100 après transplantation d’organe. 1l s’agit de carcinomes épidermoïdes de l’anus et de la région périanale, de l’urètre, du pénis, de la vulve ou du vagin. 1ls représentent 3 p. l00 des tumeurs du registre de Cincinnati et sont plus fréquents chez les femmes (75 p. 100), où un tiers des lésions sont des carcinomes in situ à la différence de ce que l’on observe chez l’homme. Ils surviennent tardivement (88 mois en moyenne) et sont souvent multiples et/ou associés à des cancers cutanés et du col utérin. Les antécédents de condylomes acuminés ou d’infection herpétique et génitale sont fréquents.
L’incidence des carcinomes in situ du col utérin est multipliée par l4 après transplantation d’organe. 1ls représentent 78 p.l00 des néoplasies cervicales et l5 p. l00 des tumeurs observées dans le registre de Cincinnati. Leur délai d’apparition est en moyenne de 58 mois. 1ls sont étroitement associés avec les HPV de type l6 et l8, mais les infections, en particulier à Herpès ou à Chlamydia, et le tabagisme sont des cofacteurs importants.
AUTRES CANCERS
L’incidence de la maladie de Kaposi, dont l’étiopathogénie exacte reste méconnue, est notablement augmentée après transplantation d’organe. Par contre, aucune observation n’a été rapportée après greffe de moelle osseuse. La maladie de Kaposi après transplantation est plus fréquente chez les patients d’origine juive d’Europe centrale, du pourtour du Bassin méditerranéen et chez les Noirs africains, avec une prédominance masculine quasi exclusive. Parmi les 7923 transplantés rénaux, cardiaques et hépatiques d’lle-de-France de l968 à l990, 4l patients ont développé une maladie de Kaposi. La fréquence du Kaposi apparaît plus élevée après transplantation hépatique, (l,42 p. 100) qu’après transplantations rénale (0,45 p. 100) et cardiaque (0,41 p. l00). Sous ciclosporine, 1’incidence du Kaposi augmente, son apparition est plus précoce en règle au cours de la première année et son évolution plus sévère. L’évolution de la maladie est fonction de l’extension des lésions lors du diagnostic et des possibilités de réduire l’immunosuppression. Les formes viscérales (stade 3,4) sont les plus graves ; les formes cutanées (stade l,2) plus fréquentes après transplantation rénale (62-75p.l00 des cas) qu’après transplantations hépatique (44p.100 des cas) et cardiaque (50 p.l00 des cas), évoluent vers 1a rémission dans 52 p. l00 des cas. Le décès est p1us souvent 1ié aux complications secondaires à la chimiothérapie (infections, hémorragies digestives) qu’à la masse tumorale elle-même. Le traitement n’est pas encore codifié : après transplantation réna1e, la survie du malade au prix du retour en dialyse doit être préférée à la mise en jeu du pronostic vital par maintien de l’immunosuppression. Après transplantation cardiaque ou hépatique, il est difficile de réduire l’immunosuppression du fait du risque de rejet fatal, et la chimiothérapie par voie générale aux stades 3-4 (vincristine, bléomycine, actinamycine + adriamycine ou dacarbazine) favorise les infections sévères associées.
Les leucémies aiguës et syndromes myélodysplasiques ont une incidence discrètement augmentée (0,1 p.l00 à 0,8p.l00) chez 1es transplantés d’organe par rapport à la population générale. La grande majorité sont des leucémies myéloïdes aiguës ou chroniques. Un des facteurs incriminés est l’utilisation prolongée d’azathioprine. Après greffe de moelle, le développement d’une nouvelle leucémie, d’un type différent de la leucémie initiale, est rare, comparé au risque de récidive de l’hémopathie première. Le nombre de cas est trop faible pour supporter la théorie d’un effet leucémogène des cellules greffées à partir du donneur.
Les carcinomes hépato-biliaires ont une incidence fortement augmentée chez les patients transplantés porteurs de l’antigène HBs.
Tous les autres cancers à l’exception notable des cancers mammaires et prostatiques, ont une fréquence légèrement accrue, et comme certains d’entre eux sont par ailleurs déjà très fréquents dans la population générale (cancer colique et bronchique), leur survenue est possible chez un greffé d’organe ou de moelle et pose essentiellement des problèmes thérapeutiques.
DONNEES THERAPEUTIQUES
Il est impossible, compte tenu de l’hétérogénéité des tumeurs observées (site, stade, délai) et des patients (type de transplantation et d’immunosuppression), d’entrer dans la spécificité de chaque cas, mais certaines options thérapeutiques sont communes chez tous les greffés cancéreux. Le traitement chirurgica1 est, bien sûr, 1e premier à discuter, en particulier pour les tumeurs localisées, les tumeurs cutanées et ano-génitales. La radiothérapie peut être utile en cas de cancers ano-génitaux invasifs, localement avancés ou avec un envahissement ganglionnaire. La chimiothérapie doit être réservée aux formes avancées ou métastatiques, quand son efficacité est prouvée dans l’indication traitée et qu’un bénéfice pour le patient est probable ou certain. Se pose alors le problème des risques de toxicité des anticancéreux pour le greffon, de toxicité médullaire cumulative potentielle (avec l’azathioprine), ou d’interactions pharmacologiques. L’interféron est formellement contre-indiqué après transplantation.
L’autre versant thérapeutique est l’éventuelle réduction du traitement immunosuppresseur, qui dépend de l’organe greffé, du délai postgreffe et du type d’immunosuppression. Quand le transplant est un organe vital, cette réduction consiste à arrêter l’azathioprine et à utiliser les plus faibles doses possibles de ciclosporine. Chez le transplanté rénal, il est possible d’arrêter toute immunosuppression avec, au besoin, un retour en dialyse.
En cas de prolifération lymphoïde, les indications thérapeutiques restent mal codifiées. Les hyperplasies B polymorphes et les lymphomes B polymorphes à contingent monoclonal mineur sont susceptibles de régresser totalement après réduction de l’immunosuppression et sous aciclovir. Compte tenu du rôle probable de l’EBV dans l’oncogénèse observée, l’aciclovir et le ganciclovir sont utilisés pour diminuer l’immunosuppression induite par la réplication virale active, mais restent sans effet sur les cellules infectées de façon latente. Par contre, les lymphomes B monoclonaux nécessitent un traitement plus agressif Dans les tumeurs extraganglionnaires localisées, en particulier digestives, la chirurgie d’exérèse complète peut être curative. Dans les localisations non accessibles à la chirurgie ou dans les formes disséminées, la radiothérapie ou à la chimiothérapie classique semblent nécessaires ; le pronostic est alors sombre, avec une mortalité d’au moins 80p.l00. La ciclosporine potentialiserait les effets des substances cytotoxiques, mais en diminuerait la tolérance. Certains anticorps monoclonaux ont été récemment utilisés avec succès dans quelques cas isolés.
Bien entendu, l’incidence de ces cancers doit être diminuée par une sélection des donneurs et la connaissance des risques de cancer; l’incidence des formes invasives le sera par un dépistage et un diagnostic précoces après transplantation.
La Peau Après Transplantation d’Organe et Greffe de Moëlle Osseuse
- Auteurs: C. FRANCES ET D. FARGE
- Ouvrage: Traité de Médecine (3ème édition), éd. Flammarion
- Date de publication: septembre 1996
Nous sommes conscients que cet article est relativement ancien; toutefois, il renferme des renseignements qui vous seront sans doute utiles; aussi l’avons-nous laissé en ligne. Par ailleurs, si vous disposiez d’articles plus récents sur le même sujet, n’hésitez pas à nous en faire part afin de demander leur autorisation à leurs auteurs pour une publication en ligne sur ce site
- Complications cutanées des immunosuppresseurs
- Infections cutanées
- Tumeurs cutanées
- Maladie cutanée du greffon contre l’hôte
Après greffe d’organe’ la majorité des manifestations cutanées en relation avec l’insuffisance de 1’organe transplanté régressent en que1ques mois. 11 en est ainsi du prurit’ de 1a mélanodermie diffuse qui contribue avec 1’anémie au teint terreux des insuffisants rénaux’ ou de la circulation collatérale’ de 1’ictère et des angiomes stel1aires des insuffisants hépatiques. En revanche’ d’autres lésions cutanées sont observées. L’atteinte cutanéo-muqueuse est au premier p1an de 1a GVH’ survenant es sentiel1ement après greffe de moe1 le osseuse. Les immunosuppresseurs ont des effets secondaires cutanéo-muqueux divers et fréquents’ favorisant l’apparition des infections dermatologiques’ p1us graves sur ce terrain. Les 1ésions tumorales cutanées multiples favorisées par l’immunosuppression atteignent p1us volon tiers le transplanté d’organe.
COMPLICATIONS CUTANEES DES IMMUNOSUPPRESSEURS
Que 1e traitement immunosuppresseur soit maintenu à vie comme chez les transp1antés d’organe ou transitoirement après greffe de moel1e osseuse’ i1 est directement responsab1e de lésions cutanées spécifiques.
Corticotherapie générale prolongée
Elle induit un aspect cushingo.ïde’ une atrophie cutanée et une acné. Ces manifestations sont dose-dépendantes avec une susceptibilité individuelle différente.
Ciclosporine
Elle a aussi des effets cutanéo-muqueux’ dose-dépendants’ dominés par 1′ hypertrichose’ d’ intensité variable selon la susceptibilité individuel1e. L’hypenrophie gingivale apparaît à partir du 4e mois de traitement; elle est favorisée par une mauvaise hygiène buccale et aisément réduite par gingivectomie chirurgicale ou au laser CO2.
Sérum antilymphocytaire poly ou monoclonal
Son utilisation est souvent associée à la survenue d’éruptions morbi1liformes’ scar1atiniformes ou urticariennes’ voire d’_dème de Quincke ou de maladie sérique. Ces réactions’ prévenues par l’adjonction systématique d’antihistaminiques et de cortico’ïdes’ sont liées à l’ apparition d’ anticorps dirigés contre les protéines animales. El1es semb1ent moins fréquentes avec les globulines antithymocytaires de 1apin qu’avec le sérum anti1ymphocytaire de cheval.
INFECTIONS CUTANEES
L’immunodépression iatrogène explique la fréquence et la gravité des lésions infectieuses chez tous les greffés.
INFECTIONS VIRALES
Les infections du groupe Herpès virus’ essentiellement à VZV et HSV’ ont volontiers une évolution prolongée et une extension inhabituelle. Ainsi’ des récurrences peuvent prendre l’aspect de primo-infections. Le recours aux antiviraux’ en particulier à l’aciclovir’ est plus large que chez le sujet immunocompétent. Etant donné la sensibilité différente de l’Herpès virus et du virus varicelle-zona à l’aciclovir’ il est important d’avoir un diagnostic précis clinique ou virologique. La sérologie a un intérêt très limité. Tout zona doit être étroitement surveillé et traité par aciclovir intraveineux en cas d’extension à plusieurs racines’ de lésions nécrotiques ou hémorragiques ou de localisation considérée comme à _ risque _ (cervicale’ périnéale…). La forme orale n’est pas utilisée dans le zona’ mais est utile en cas de récurrence herpétique d’extension limitée. Les primo-infections herpétiques et les récurrences extensives justifient la forme intraveineuse. La durée du traitement est de 3 semaines pour une récurrence et de 6 semaines pour une primo-infection’ avec traitement intraveineux initial de 10 à 15 jours puis relais per os. L’efficacité de la forme locale n’est pas démontrée chez le transplanté. Le risque de surinfection bactérienne justifie la prescription systématique d’antiseptiques.
Les infections cutanées à Papillomavirus’ plus particulièrement les verrues vulgaires ou planes’ sont volontiers multiples’ localisées préférentiellement sur les zones exposées et d’évolution chronique [3]. Elles sont observées chez 30p.l00 des transplantés d’organe. En revanche’ leur fréquence ne semble pas augmentée chez les greffés de moelle osseuse par rapport à une population témoin. Du fait du r6le carcinogène qui leur a été attribué’ il est important de les détruire; différentes techniques étant possibles : cryothérapie’ applications de kératolytiques’ voire laser CO2 ou exérèse chirurgicale. Quelle que soit la méthode utilisée’ les récidives sont fréquentes’ nécessitant une surveillance étroite.
INFECTIONS MYCOSIQUES
Les infections mycosiques cutanées du transplanté d’organe’ comme celle du greffé de moelle, sont assez voisines de celles du sujet immunocompétent. Les intertrigos dermatophytiques’ fréquemment fissurés’ constituent une pone d’entrée pour les infections bactériennes. Les antifongiques locaux sont largement utilisés. En cas d’extension importante ou de dermatophyte nécessitant un traitement par voie orale’ la terbinafine sera utilisée de préférence’ du fait de l’absence d’interaction avec la ciclosporine. Le pityriasis versicolor’ malgré son extension souvent notable’ est traité localement par des antifongiques à large spectre.
INFECTIONS BACTERIENNES
Surtout dues à des cocci à Gram positif’ elles apparaissent dès qu’il y a une rupture’ traumatique ou infectieuse (virale ou mycosique)’ de la barrière cutanée. Ce risque justifie la prescription large d’antiseptiques à la moindre effraction cutanée. Les folliculites sont traitées par voie locale’ à moins qu’un foyer staphylococcique n’ait été mis en évidence par les prélèvements bactériologiques systématiques des orifices. Une simple folliculite doit être différenciée d’une acné induite par les cortico’ïdes et volontiers surinfectée. Cette dernière justifie un traitement antiacnéique’ notamment par les rétino.ïdes locaux. Les furoncles’ abcès’ cellulites et érysipèles ont une évolution sévère et rapide’ justifiant un traitement précoce en milieu hospitalier: furoncles et abcès sont largement excisés; l’antibiothérapie parentérale et bactéricide est débutée sans attendre les résultats des prélèvements locaux et des hémocultures systématiques’ puis adaptée à la nature du germe selon l’antibiogramme’ avec mesure du pouvoir bactéricide du sérum. La durée du traitement est fonction de la sévérité de l’extension cutanée’ au minimum 3 semaines’ sans méconnaître le risque toujours possible d’extension aux tendons et à l’os sousjacents.
TUMEURS CUTANEES
La fréquence de certaines tumeurs cutanées bénignes ou malignes est plus élevée chez les transplantés d’organe immunosupprimés à vie que dans une population témoin [l]. Ce phénomène est moins marqué chez les greffés de moelle’ car le traitement immunosuppresseur n’est que transitoire; néanmoins’ les nævus nouveaux et dysplasiques sont plus fréquents après greffe de moelle osseuse allogénique’ et le cancer cutané est la seconde complication cutanée’ après l’infection’ de la GVH chronique.
KERATOSES
Elles sont localisées principalement sur les zones exposées. Leur évolution habituelle est très lente’ avec possibilité de transformation en carcinome spinocellulaire. Après transplantation d’organe’ la fréquence de ces kératoses varie selon l’âge’ l’exposition solaire totale’ la carnation et l’ancienneté du traitement immunosuppresseur. Ainsi’ en Grande-Bretagne’ 7’4 p.100 des transplantés rénaux ont des kératoses’ contre 24 p.l00 en Australie. Une surveillance rigoureuse est nécessaire du fait des récidives particulièrement fréquentes et d’une transformation maligne plus rapide. Ces kératoses doivent être traitées systématiquement par cryothérapie ou applications locales de 5- fluoro-uracile. Au moindre doute de transformation ou en présence d’une infiltration’ l’exérèse chirurgicale avec examen anatomo- pathologique complet de la pièce est nécessaire. Une photoprotection est indispensable.
KERATO-ACANTHOME
C’est théoriquement une lésion bénigne’ régressant spontanément en plusieurs mois. Chez les greffés’ sa ressemblance habituelle avec un carcinome spinocellulaire oblige à ne pas attendre la régression spontanée et à pratiquer d’emblée une exérèse chirurgicale avec contrôle histologique pour ne pas risquer de laisser évoluer une tumeur maligne. De plus’ l’existence simultanée de carcinomes spinocellulaires et de kérato-acanthomes est un phénomène connu.
MALADIE DE BOWEN
Elle est volontiers atypique chez les transplantés’ se présentant comme une kératose’ un kérato-acanthome’ une verrue ou un carcinome spinocellulaire. Aussi’ la confirmation histologique du diagnostic estelle indispensable avant d’envisager une destruction locale par laser CO2 ou cryothérapie. Au moindre doute diagnostique’ l’exérèse chirurgicale est préférable. Une surveillance ultérieure est indispensable’ en raison du risque de récidive et de l’association fréquente avec d’autres tumeurs cutanées.
CARCINOMES CUTANES
Il existe une nette prédominance des carcinomes spinocellulaires (s) par rapport aux basocellulaires (b) chez les transplantés (s/b = 2)’ contrairement à une population témoin non immunodéprimée (s/b = 0’l4); les Iésions sont volontiers multiples’ avec une distribution anatomique prédominant sur les zones exposées’ comme dans 1a popu1ation témoin. Chez 1es greffés de moe11e atteints de GVH chronique’ 1a préva1ence des carcinomes spinocel1ulaires semb1e accrue dans 1a bouche et sur la peau. Les carcinomes spinocel1u1aires ont un aspect souvent atypique chez 1e transp1anté : nodule u1céré évoquant des kérato-acanthomes ou verrue vulgaire à base parfois érythémateuse ou dou1oureuse. Les carcinomes basoce1lulaires n’ont pas de particularité séméio1ogique et conservent un grand polymorphisme c1inique : lésion perlée’ pigmentée’ ulcérée’ cicatricie1le’ sclérodermiforme ou érythémato-squameuse pouvant simu1er une ma1adie de Bowen. Dans certains cas’ heureusement re1ativement peu nombreux’ l’évolution de ces carcinomes est très sévère’ avec extension profonde et destructrice’ risque de disséminahon fatale.
Les expositions solaires, l’âge – de 20 à 30 ans p1us jeune chez les transplantés que dans une population témoin_’ la durée du traitement immunosuppresseur et probablement’ dans certains cas’ une infection vira1e à Papi11omavirus (HPV) interviennent dans la genèse de ces carcinomes. Le rôle des HPV est étayé par : le parallélisme épidémiologique entre verrues et carcinomes épidermo.ïdes chez les greffés’ la fréquence de l’existence de signes histologiques d’infection vira1e à HPV en périphérie de la pro1ifération et enfin la découverte dans les lésions tumorales’ par hybridation in situ’ d’ADN viral de plusieurs types de Papillomavirus humains’ dont certains oncogènes (HPVl’ 2′ 4′ 5′ 8′ l6′ l8).
Le traitement des carcinomes cutanés est essentiellement chirurgical’ avec exérèse de la lésion. En cas de carcinome infiltrant à « haut risque », la baisse du traitement immunosuppresseur doit être envisagée; une chimiothérapie est souvent nécessaire. La prévention des carcinomes repose sur la destruction systématique des dermatoses pré-épithé1iomateuses tel1es que 1es kératoses et la ma1adie de Bowen.
MELANOME MALIN
La fréquence du mélanome malin serait 2 à 5 fois plus élevée chez 1e transplanté d’organe par rapport à des témoins appariés quant à l’âge’ au phototype et à l’exposition solaire; en revanche’ leur prévalence ne semble pas augmentée après greffe de moelle osseuse. Leur traitement est essentiellement chirurgical’ comportant l’exérèse plus ou moins large suivant l’extension de 1a tumeur’ appréciée sur 1’épaisseur de 1a lésion par l’indice de Breslow et son envahissement en profondeur se1on Clark. Leur prévention justifie l’exérèse systématique de tout nævus suspect. Un naevus est suspect s’il s’étend en surface et/ou devient po1ychrome à contours polycycliques ou surface irrégu1ière.
MALADIE DE KAPOSI
Elle est une pro1ifération endothéliale mu1ticentrique’ de nature possib1ement réactionnel1e (voir chapitre 825). Sa héquence nettement augmentée après transplantation d’organe par rapport à une population contrôle est ainsi multipliée par 400 après greffe rénale. Elle est exceptionne1le après greffe de moe1le osseuse. La confirmation histologique du diagnostic est indispensab1e’ montrant une double prolifération ce1lu1aire constituée de cel1u1es fusiformes et vasculaires avec réaction de Perls positive. La topographie des 1ésions est variable’ avec atteinte muqueuse fréquente et vo1ontiers asymptomatique au début.
Quatre stades évolutifs définis par Khader sont utiles’ à visée pronostique préthérapeutique : lésion(s) cutanée(s) 1imitée(s) à un seul membre (stade l ) ou diffuse(s) (stade 2); formes extensives avec atteinte(s) viscérale(s) (stade 3) ou associées à une infection grave ou à une autre prolifération maligne (stade 4).
La conduite thérapeutique n’est actue11ement pas codifiée et dépend de l’organe transp1anté et de 1’extension du Kaposi. Dans tous 1es cas’ 1’inmunosuppression est réduite a minima. Une destruction des lésions cutanées n’est envisagée qu’en cas de gêne fonctionnelle ou esthétique (cryothérapie’ chirurgie’ 1aser…). Une extension ga1opante des lésions ma1gré 1a baisse de l’immunodépression ou un risque potentiel vital justifient un traitement chimiothérapique : monochimiothérapie (vinblastine’ VPl6 ou b1éomycine)’ voire polychimiothérapie’ qui accentue alors l’immunosuppression et 1e risque d’infections opportunistes.
MALADIE CUTANEE DU GREFFON CONTRE L’HOTE
La peau est une des localisations privilégiées de la maladie du greffon contre l’hôte (GVH)’ observée fréquemment après greffe de moe1le osseuse’ exceptionne1lement après transplantation d’organe ou transfusions (voir chapitre 8l0). En effet’ se1on Bi1lingham en 1966′ les manifestations patho1ogiques de 1a GVH apparaissent lorsque 3 conditions sont réunies : a) greffe d’un organe contenant des cel1ules immunitaires; b) différence d’histocompatibilité entre donneur et receveur; c) déficit immunitaire du receveur. Les mécanismes physiopathologiques exacts de la GVH restent à élucider et ses manifestations cliniques ont été arbitrairement séparées de manière chronologique entre aiguës ou chroniques’ selon qu’elles surviennent respectivement avant ou après le l00ejour postgreffe.
GVH AIGUE
L’atteinte cutanée quasi constante est la p1us évocatrice des manifestations de 1a GVH aiguë. La fréquence de 1a GVH aiguë varie de 6 à 90 p. l 00 se1on l’ âge’ l’incompatibi1ité HLA et 1es protocoles de prévention adoptés; chez l’adulte après greffe de moel1e HLA- identique’ l’incidence moyenne est de 35 p. l00. El1e se manifeste le plus souvent entre J7 et J2l après la prise de greffe’ par un exanthème maculo-papuleux’ disséminé’ à début aigu’ prenant une disposition morbil1iforme ou scarlatiniforme. L’atteinte pa1mo-p1antaire et auricu1aire est relativement évocatrice’ avec nappes érythémateuses et éventuel1e desquamation; l’érythème buccal est fréquent. Très rarement survient une fragilité épidermique avec bulles et décollement’ correspondant au syndrome de Lyell-GVH. Quatre stades cliniques sont définis selon l’étendue des lésions’ dont la sévérité est corrélée au pronostic. La biopsie cutanée systématique apporte des éléments diagnostiques (avec 4 stades de sévérité croissante) devant 1a présence d’un infiltrat 1ymphocytaire dans le derme superficiel à 1a jonction dermo-épidermique et d’une vacuolisation ou nécrose des kératinocytes’ plus particulièrement de 1’assise basa1e et des fo1licules pi1eux’ qui’ très intense’ peut être responsable d’un c1ivage dermo-épidermique avec décol1ement cutané. Les données immuno-histochimiques sont contradictoires’ mais toutes plaident pour un phénomène de cytotoxicité directe des ce1lules CD4+ ou CD8+ avec action des cytokines produites par 1es cel1ules T activées (TNF’ perforine…)’ dont témoignent la présence d’un infiltrat T CD8+’ CD4+ ou mixte; 10 à 30 p. 100 des ce1lu1es 1ymphoïdes sont des cellules NK; il n’y a pas de lymphocytes B.
Ces manifestations cutanées’ cliniques ou histo1ogiques’ ne sont pas spécifiques et peuvent s’observer notamment au cours de toxidermies ou d’infections virales. Le diagnostic est conforté par la présence d’une atteinte hépatique ou digestive. Le traitement de la GVH aiguë repose sur 1a corticothérapie à fortes doses (1 à 3 mg/kg/j)’ plus rarement 1a cic1osporine; cyc1ophosphamide et sérum antilymphocytaire sont réservés aux fonnes sévères. Le thalidomide serait une alternative dans les cas difficiles. Le traitement du syndrome de Lyell-GVH est décevant’ avec une mortalité proche de 100 p. 100′ liée à la sévérité des autres atteintes viscérales de la GVH et aux surinfections cutanées.
GVH CHRONIQUE
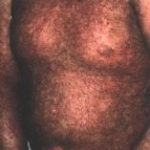
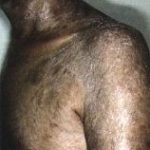
La peau est atteinte dans presque tous les cas de GVH chronique dont la prévalence elle-même atteint 30 à 50 p. l00 chez les greffés de moelle allogénique ayant survécu plus de 6 mois. La GVH chronique cutanée se manifeste principalement par des lésions lichéniennes et sclérodermiformes concomitantes ou successives.
Les lésions lichéniennes papules violines ou érythémateuses à surface discrètement squameuse plus ou moins confluentes’ atteignent surtout la région périorbitaire’ les oreilles’ les paumes des mains (avec parfois aspect trompeur d’une dyshydrose) et les plantes des pieds; elles se localisant fréquemment sur des zones de traumatismes’ d’infection ou de radiothérapie. L’atteinte endobuccale’ associée dans 90 p. l00 des cas’ est un lichen plan buccal avec 1ésions 1eucop1asiques des joues’ de 1a 1angue’ du palais ou des lèvres et dans les formes les plus sévères’ des érosions mu1tip1es douloureuses. Un syndrome sec bucca1 et oculaire est quasi constant’ responsable de surinfections candidosiques. Les ongles peuvent être atteints avec une onychoatrophie et des ptérygions’ les organes génitaux également avec risque de phimosis.
Les lésions sclérodermiformes forment des plaques indurées scléreuses mal limitées avec hyperpigmentation précoce ou poïkilodermie en regard. Ces lésions sont 1oca1isées’ électivement aux grands plis et aux membres inférieurs’ ou généralisées à début inflammatoire’ ou d’emblée sc1éreuses et a1ors extrêmement invalidantes. La rétraction fibreuse avec adhérence de la peau aux p1ans profonds entrame des ulcérations mécaniques très lentes à guérir. Hi sto1ogiquement’ 1es 1és ions 1ichén i ennes précoc e s res ssemb1ent aux images de GVH aiguë avec infiltrat 1ymphoïde dermique et épaississement de 1’épiderme associés à une nécrose kératinocytaire p1us ou moins importante. Les lésions sclérodermiformes tardives correspondent à une atrophie épidemmique marquée’ avec destruction progressive des annexes et fibrose co1lagène du derme papi1laire et réticulaire. En immuno-histochimie’ 1’infi1trat 1ymphocytaire T est CD3+’ CD8+’ et 1a fibrose ll constituée de procollagène 111.
Les lésions lichénoïdes sont assez bien contrô1ées par les corticoïdes (l mg/kg/j de prednisone initia1ement) associés aux immunosuppresseurs (azathioprine 1’5 mg/kg/j) pendant une durée habitue1le de 9 à 12 mois se1on l’évolutivité des lésions; la réponse est plus variab1e dans 1es formes sc1érodermiformes. La photothérapie et 1es autres traitements par voie généra1e (D-pénici11amine’ irradiation lymphoïde tota1e’ échanges plasmatiques) sont encore à éva1uer. Prévention des infections’ a1imentation hyperprotidique’ larmes artificie1les’ protection so1aire’ hydratation cutanée sont des éléments importants du traitement symptomatique à ne pas nég1iger.
Aspects Psychologiques et Psychiatriques Après Traitements par Greffe
- Auteurs: S. M. CONSOLI ET M. BAUDIN
- Ouvrage: Traité de Médecine (3ème édition), éd. Flammarion
- Date de publication: septembre 1996
Nous sommes conscients que cet article est relativement ancien; toutefois, il renferme des renseignements qui vous seront sans doute utiles; aussi l’avons-nous laissé en ligne. Par ailleurs, si vous disposiez d’articles plus récents sur le même sujet, n’hésitez pas à nous en faire part afin de demander leur autorisation à leurs auteurs pour une publication en ligne sur ce site
- Evaluation psychologique avant greffe
- Complications psychiatriques des greffes
- Représentation de la greffe et de l’organe greffé
- Réadaptation sociale et qualité de vie du greffé
L’attente d’une transplantation d’organe ou d’une greffe de moel1e osseuse, sa réalisation, la haute surveillance médicale qui caractérise les suites opératoires constituent une série d’épreuves qui engagent en profondeur les capacités de résistance physique et morale des patients auxquels ces techniques s’adressent. Les équipes de transplantation ont progressivement pris l’habitude de s’associer le concours de psychiatres et de psychologues, aussi bien pour évaluer la faisabilité d’un tel projet de soin et tenter de prévenir les différents accidents de parcours de type comportemental ou émotionnel, que pour apporter une aide spécifique aux futurs greffés et aux greffés au cours des périodes les plus difficiles du suivi.
L’utilité de la collaboration des psychiatres et psychologues s’étend à l’entourage des greffés et aux équipes soignantes. En effet, la greffe constitue aussi une véritable épreuve pour la famille du patient, qui le plus souvent vient de vivre des angoisses multiples, liées à l’évolution d’une maladie chronique vers la phase terminale. Même éprouvée, cette famille conserve un rôle de premier plan, et sa participation active à la prise en charge du patient mérite d’être soutenue.
Enfin, le psychiatre et le psychologue apportent aussi leur soutien à l’ensemble de l’équipe soignante à l’occasion de réunions d’équipe, visant essentiellement l’expression des difficultés de prise en charge des patients : déception lorsqu’un patient ne répond pas à l’attente générale de l’équipe, hostilité lorsque des patients ne se montrent pas assez coopérants, difficultés à faire le deuil de patients particulièrement investis en cas de décès ou tout simplement lors de leur sortie.
EVALUATION PSYCHOLOGIQUE AVANT GREFFE
Principaux objectifs de l’evaluation psychologique
L’objectif initial de cette évaluation est de mettre en évidence l’existence de contre-indications psychiatriques à la greffe’ en précisant notamment le risque de non-observance médicamenteuse ultérieure. La non-observance peut alors’ en effet’ constituer une menace vitale immédiate ; dans tous les cas’ elle compromet gravement les efforts déployés jusque-là par l’équipe soignante et par le patient lui-même. Seuls l’alcoolisme récent et la toxicomanie’ qui témoignent d’un jeu avec la mort’ semblent être dissuasifs pour la plupart des équipes. L’évaluation de l’observance antérieure doit être nuancée’ car elle peut être liée à l’échappement itératif aux différentes thérapeutiques proposées’ toutes plus ou moins palliatives. Elle ne saurait donc’ à elle seule’ présager d’une mauvaise observance ultérieure quant à la prise de la ciclosporine. Par contre’ le non-respect des consignes diététiques dans le passé est certainement un élément de pronostic péjoratif.
Les greffes cardiaques et hépatiques se situent souvent dans un contexte d’urgence où le pronostic vital est en jeu. Il n’en est pas tout à fait de même pour les greffes de rein’ puisque reste la possibilité d’attendre en dialyse le meilleur moment psychologique pour pratiquer la greffe. L’existence d’antécédents psychiatriques ne prédit pas forcément une observance défectueuse. La greffe reste possible dans de nombreux cas psychopathologiques : psychose équilibrée’ psychose maniaco-dépressive’ troubles de la personnalité. Le role du psychiatre ne sera pas de mettre à l’écart de tels patients’ mais de prévoir dès l’évaluation une aide adaptée.
Le deuxième temps de cette évaluation consiste à repérer’ au moyen d’un entretien semi-directif’ le fonctionnement psychique actuel et passé du patient’ avec une attention particulière aux capacités d’adaptation du patient face aux événements traumatiques de sa vie (deuils’ maladies antérieures). Chaque fois que possible’ l’entourage du patient’ notamment le conjoint’ mérite d’être rencontré et évalué à son tour’ d’abord dans le but de rassembler le maximum d’informations sur le patient’ sur sa place dans la famille’ ses capacités d’adaptation’ mais surtout pour évaluer la qualité du support que constitue l’entourage et mesurer le degré d’implication de ce dernier dans le projet de greffe. En cas de transplantation d’organe pour un enfant’ il importe d’évaluer l’investissement parental dans ce projet à long terme. Des changements dans les relations familiales ont été mis en évidence’ en particulier lorsqu’il s’agit d’un donneur apparenté.
Peu d’attention a été portée à l’évaluation du donneur’ mais certains la proposent systématiquement’ en particulier en cas de greffe rénale ou de greffe de moelle avec un donneur vivant apparenté : sont ainsi pris en compte la stabilité psychique’ la structure de personnalité’ le degré de motivation du donneur’ l’existence de pressions familiales pour le don.
Facteurs psychologiques et pronostic vital
Diverses caractéristiques psychologiques relevées lors du bilan avant greffe permettent de prédire la survie des greffés cardiaques à 2 ans de l’intervention’ indépendamment de la gravité de la défaillance cardiaque terminale conduisant à la greffe: un plus grand élan vital’ des relations affectives ou des investissements sociaux stables’ enfin’ et de manière très significative’ la faculté de réprimer l’angoisse de mort. Ce dernier élément souligne la fonction protectrice d’une retenue émotionnelle dans un contexte de menace vitale majeure. L’évaluation de la stabilité du couple’ de la répartition des r6les familiaux’ de l’implication du conjoint dans le projet de la greffe est essentielle’ car de tels éléments semblent’ eux aussi’ comporter une valeur pronostique considérable.
COMPLICATIONS PSYCHIATRIQUES DES GREFFES
Période prégreffe
Pour la majorité des patients présentant une défaillance organique grave’ la période prégreffe est associée à un déclin physique rapide’ voire à un état d’invalidité totale. Les insuffisants rénaux sous dialyse peuvent’ dans la plupan des cas’ maintenir une insertion socio-professionnelle et une autonomie acceptable. La lourdeur de la réalité vécue et les conséquences directes des défaillances organiques sousjacentes’ des traitements administrés’ expliquent la fréquence des troubles anxio-dépressifs et des psycho-syndromes organiques alors observés. Les troubles anxio-dépressifs nécessitent avant tout’ en tant que troubles de l’adaptation’ un soutien psychologique approprié du patient (voire de son entourage)’ en favorisant la verbalisation mais sunout en renforçant les capacités à _ faire face _ à une réalité mena,cante. Le traitement de l’anxiété et de la dépression peut aussi nécessiter des psychotropes: chez les insuffisants rénaux’ les antidépresseurs sont généralement bien tolérés’ en prenant garde à l’élimination rénale de la plupart des produits ; chez les insuffisants cardiaques’ les antidépresseurs de nouvelle génération seront préférés aux tricycliques classiques’ qui présentent des risques cardiotoxiques.
Suites de greffe
TROUBLES ANXIEUX
Ce sont les plus fréquents. Leur survenue est aisément compréhensible dans un contexte de complication postopératoire’ de traitements contraignants ou à l’occasion d’un épisode de rejet. Il impone également de tenir compte d’un _ effet de soupape _ chez des patients qui ont déployé d’énormes efforts pour contrôler leurs émotions en période préopératoire et se permettent plus de spontanéité lorsque le danger commence à s’éloigner.
TROUBLES DE L’HUMEUR
Egalement fréquents’ ils s’observent la plupan du temps à la sonie de réanimation ou en fin d’hospitalisation’ lorsque les patients se retrouvent dans leur contexte familial. La dépression accompagne souvent un vécu de désillusion: elle peut en effet résulter d’attentes insatisfaites ou de difficultés relationnelles que la greffe n’a pu’ magiquement’ effacer. Par ailleurs’ toute greffe’ même celle dont l’issue est favorable’ implique un travail de deuil inévitable: deuil d’une fonction corporelle ou d’un organe’ dont le greffon vient prendre le relais’ deuil parfois des relations privilégiées qui s’étaient nouées entre le patient et l’équipe soignante (c’est le cas de certains insuffisants rénaux en dialyse)’ deuil aussi du donneur anonyme dont la mort a pu être secrètement souhaitée pour que la greffe puisse avoir lieu.
CONFUSION MENTALE
Elle est surtout observée chez les transplantés cardiaques’ cardio-pulmonaires et hépatiques dans la période postopératoire immédiate. Elle est nettement moins fréquente depuis la baisse des doses de conicoïdes nécessaires’ grâce à la ciclosporine.
EPISODE PSYCHOTIQUE AIGU
Il peut survenir plusieurs jours (parfois 2 à 4 semaines) après l’intervention. Les thèmes du délire sont variables’ souvent à type de persécution’ mais il peut s’agir également du déni de l’intervention elle-même ou encore du déni de l’affection causale. Chez le transplanté cardiaque’ la survenue de tels troubles semble plus en rapport avec la longueur du séjour en réanimation (une semaine environ) qu’avec la toxicité de la circulation extracorporelle. Pour une greffe de moelle osseuse’ l’isolement en secteur stérile dure environ 6 semaines. Aux troubles du sommeil’ à la pene des rythmes physiologiques et à l’angoisse de mon présente dans les services de réanimation’ s’ajoute’ dans les services privilégiant la technicité’ une penurbation des contacts interpersonnels’ engendrée par les précautions d’asepsie indispensables chez ces patients immunodéprimés (masques’ casaques’ gants’ etc.). Un cenain nombre de mesures contribuent à prévenir ces décompensations psychotiques : relation médecin-malade plus étroite et plus personnalisée’ tenant compte des éléments de personnalité du patient’ mise en place d’objets provenant de l’univers familier’ lutte contre les troubles du sommeil.
REPRESENTATION DE LA GREFFE ET DE L’ORGANE GREFFE
Remaniements de l’image du corps
Le plus souvent’ les patients considèrent l’organe transplanté non comme une partie d’eux-mêmes’ mais comme un objet étranger sur lequel ils n’ont aucun droit. De plus’ chaque organe est associé à des représentations imaginaires plus ou moins spécifiques : le c_ur véhicule les émotions’ le foie les humeurs… Chaque patient devra donc progressivement intégrer ce nouveau greffon aux pouvoirs plus ou moins magiques et l’assimiler comme un élément naturel. Toute greffe confronte le patient à la représentation de sa propre mort’ mais aussi à celle d’une mutilation et’ bien souvent’ à celle de la mort même du donneur (à l’exception des greffes de rein et de moelle osseuse avec donneur vivant apparenté). Mutilation et mort sont craintes et conjurées par toute une gamme de mécanismes de défense’ allant du déni massif et de l’adoption d’un discours dénué d’affects de type _ scientifique _ à une subexcitation d’allure maniaque.
Dans notre expérience’ lors des entretiens menés avant et après la greffe’ le contraste entre les attitudes et les paroles du malade et celles de leur partenaire et de leurs enfants est saisissant. Si le patient ne peut tout penser’ tout évoquer’ son entourage aborde très souvent et directement l’angoisse de mort associée à la greffe. Mais la greffe représente aussi la vie : elle est vécue comme un moyen d’effacer la maladie et comme une renaissance. Cenains auteurs ont même parlé de syndrome de Lazare. Des patients ont ainsi pu comparer leur greffon à _ un nouvel enfant _. Les épouses de greffés cardiaques peuvent vivre elles aussi l’attente de la transplantation de leur mari comme une grossesse et la réalisation de la greffe comme une mise au monde.
L’ autre thème qui apparaît très fréquemment après transplantation d’ organe concerne plus précisément le corps du patient’ possédé’ habité par l’esprit du donneur. Le patient peut avoir le sentiment parfois de _ vivre à deux dans le même corps _ ou le fantasme d’une nouvelle jeunesse’ fantasme panagé’ non sans quelque jalousie’ par le conjoint du greffé. L’identité sexuelle du donneur est aussi une source d’interrogations. C’est particulièrement le cas lorsque le donneur est de sexe oppposé et que le receveur craint d’en acquérir les caractéristiques sexuelles. A cette dimension fantasmatique s’ajoutent dans la réalité les modifications corporelles’ liées surtout aux corticoïdes’ à l’aménagement du point de biopsie’ aux cicatrices.
Dette à l’égard du donneur et de l’équipe de transplantation
Chez les greffés cardiaques, la verbalisation de fantasmes se fait sunout au cours de la période postopératoire : le donneur est évoqué’ ainsi que’ parfois’ la culpabilité du receveur d’avoir souhaité secrètement la mort d’un donneur pour que la transplantation puisse avoir lieu. Il impone d’aider le patient à surmonter un tel mouvement de culpabilité’ sans en étouffer pour autant l’expression’ et de savoir reconnaître dans les élans de gratitude du greffé à l’égard de telle infirmière _ élue _ parmi les autres’ ou de tel médecin ou chirurgien’ considéré comme un _ sauveur_’ la dimension de la dette contractée à l’égard d’un donneur anonyme et de sa famille. De retour chez eux’ certains greffés ont tendance à jouir intensément de leur vie nouvelle avec parfois l’allure d’un véritable déni de l’intervention et de ses conséquences ; d’autres’ au contraire’ entrent avec scrupule dans cette phase’ se surveillant sans cesse’ toujours prêts à revenir à l’hôpital se mettre à l’abri d’une angoisse de mourir qui ne les quitte plus; d’autres’ enfin’ manifestent une attitude de vigilance attentive à l’égard du greffon et de leur santé en général’ témoignant ainsi du respect que leur inspire le cadeau précieux qui leur a été fait.
READAPTATION SOCIALE ET QUALITE DE VIE DU GREFFE
Les résultats des publications concernant la qualité de vie du transplanté sont globalement encourageants’ tout en tenant compte des différences flagrantes entre le statut du dialysé en attente de transplantation rénale’ et celui des candidats à une transplantation cardiaque’ pulmonaire ou hépatique’ ou en attente de greffe de moelle osseuse. La majorité des greffés se déclare satisfaite de la vie quotidienne. Sont considérés par les patients comme ayant changé de façon significativement positive : l’accomplissement de soi’ la capacité de projection dans le futur’ la perception de soi’ la qualité du support social’ le sens de l’indépendance. Les greffés cardiaques expriment cependant assez fréquemment certains sympt6mes’ qui n’ont que peu d’impact sur leur satisfaction globale d’avoir été greffés’ mais posent tout de même des questions au corps médical : il s’agit de troubles en rapport avec la modification de l’aspect physique (faciès cushingo.ïde’ hirsutisme) et surtout de troubles sexuels (impuissance’ baisse de la libido).
Ces résultats’ tantôt très encourageants’ tantôt plus nuancés’ n’empêchent pas la persistance’ souvent problématique’ d’une forte dépendance médicale’ entretenue par le risque toujours présent d’un nouveau rejet’ d’une nouvelle complication du traitement anti-rejet ou d’une rechute de la maladie iuitiale’ notamment chez les greffés de moelle. Les associations de transplantés jouent un r6le certain’ en aidant les greffés à faire bon usage de leur autonomie retrouvée’ tout en préservant une alliance constructive avec le corps médical.
Toute transplantation oblige le patient à une réflexion sur ses objectifs prioritaires. Certains redécouvrent leur famille’ leurs amis’ de nouveaux centres d’intérêts’ tels que le spon ou les voyages. En contrepartie’ de nombreux greffés se heurtent à la dure épreuve de la réalité’ lorsqu’ils s’efforcent de retrouver leur statut social antérieur : déclassement professionnel’ surprotection de l’entourage’ aussi bien professionnel que familial’ difficulté à souscrire une assurance-vie sont là pour leur rappeler leur différence. Face à de telles difficultés’ certains préferent la préretraite ou l’invalidité.
Les transplantés’ surtout lorsqu’il s’agit d’organes aussi symboliques que le coeur ou le foie entretiennent une fascination dans l’imaginaire collectif qui peut cenes les valoriser’ mais aussi les piéger. Héros malgré eux’ entraînés à témoigner dans les médias sur les prodiges de la médecine moderne ou en faveur des dons d’organe’ nombreux sont ceux qui’ en privé’ expriment leur aspiration secrète à ne plus être regardés comme des êtres surnaturels et à se sentir à nouveau des _ gens comme tout le monde.
Mécanismes et Expression Clinique de la GVH
-* Auteurs : Dr Stéphane VIGNES, Pr Dominique FARGE
Service de médecine inteme, Hôpital Saint-Louis, Paris
Nous sommes conscients que cet article est relativement ancien; toutefois, il renferme des renseignements qui vous seront sans doute utiles; aussi l’avons-nous laissé en ligne. Par ailleurs, si vous disposiez d’articles plus récents sur le même sujet, n’hésitez pas à nous en faire part afin de demander leur autorisation à leurs auteurs pour une publication en ligne sur ce site
- Points forts à comprendre
- Définitions
- Principaux éléments du système immunitaire impliqués dans le rejet de greffe et de la maladie du greffon contre l’hôte
- Mécanismes et expression clinique de la maladie du greffon contre l’hôte
- GVHD aiguë
- GVHD chronique
- Points Forts à Retenir
- Pour approfondir
Points Forts à Comprendre
Les antigènes d’histocompatibilité du donneur sont les principales cibles du rejet de greffe d’organes.
La réaction du greffon contre l’hôte est le mécanisme inverse du rejet d’allogreffe : les antigènes du receveur deviennent la cible des cellules du donneur.
L’IL-2, produite par les Iymphocytes CD4+, est la principale cytokine au cours de la réaction de rejet.
Les mécanismes immunologiques complexes du rejet d’une allogreffe et de la maladie du greffon contre l’hôte font intervenir les différents éléments du système immunitaire qui concourent au rejet du non-soi par deux processus complémentaires : l’immunité cellulaire, dépendant principalement des cellules T et des cytokines, et l’immunité humorale, médiée par les anticorps produits par les cellules B. Le système immunitaire, dont le rôle est de protéger l’individu contre toute substance étrangère, est caractérisé par sa spécificité pour l’antigène, sa capacité à distinguer les antigènes du soi et du non-soi et enfin par sa mémoire pour permettre une réponse anamnestique plus forte lors de la réintroduction de l’antigène initial. Parmi les nombreuses substances antigéniques faisant l’objet d’un polymorphisme au sein de l’espèce (allotypes), la principale cible du rejet de greffe est l’ensemble des antigènes tissulaires, codés par des gènes exprimés à la surface des membranes cellulaires, définissant les systèmes d’histocompatibilité. Trois principaux systèmes interviennent dans le rejet de greffe:
1) le système des groupes sanguins ABO et Lewis correspond à des molécules tissulaires très fortement antigéniques;
2) le système HLA (Human Leucocyte Antigen) code pour l’identité du soi (HLA classe 1) et le contrôle du rejet du non-soi (HLA classe II);
3) un ensemble d’autres systèmes d’histocompatibilité appelés mineurs qui codent pour des antigènes de transplantation présentés sous forme de peptides en association avec les produits du complexe majeur d’histocompatibilité (CMH) du donneur ou du receveur.
L’expression clinique du rejet d’allogreffe est étroitement liée à la nature de l’organe greffé, à l’intensité du rejet (suraigu, aigu ou chronique) et aux possibilités de manipuler la réponse immunologique du receveur afin d’éviter la réaction de rejet par le receveur en cas de greffe d’organe, ou par le greffon lui-même vis-à-vis de son hôte en cas de greffe de moelle.
Définitions
Autogreffe: greffe d’organe ou de tissus lorsque donneur et receveur sont le même individu.
Greffe syngénique: greffe d’organe ou de tissus d’un donneur à un receveur génétiquement identique (jumeaux homozygotes).
Allogreffe: greffe d’organe ou de tissus d’un donneur à un receveur génétiquement différent au sein d’une même espèce.
Xénogreffe ou hétérogreffe: greffe d’organe ou de tissus d’un donneur à un receveur appartenant à deux espéces animales différentes.
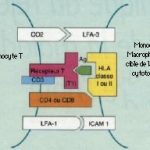
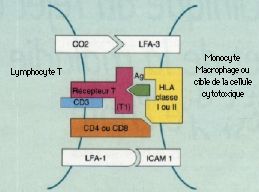
Principaux éléments du système immunitaire impliqués dans le rejet de greffe et de la maladie du greffon contre l’hôte
Cellules
1. Cellules présentant l’antigène
Les cellules de la lignée monocytes-macrophages, comprenant les monocytes du sang circulant et les macrophages tissulaires, constituent les principales cellules présentatrices d’antigènes aux lymphocytes T. L’antigène étranger est capté, internalisé, puis dégradé par une action enzymatique. Cette transformation produit des peptides allogéniques, qui sont ensuite exprimés à la surface des monocytes macrophages en association avec les molécules HLA de classe II. Cette étape s’accompagne, entre autres, de la sécrétion de cytokines (Tumor necrosis factor a, interleukine 1, interleukine 6) et d’enzymes (protéases, Iysozyme) par le monocyte-macrophage. D’autres cellules non phagocytaires peuvent intervenir dans la présentation de peptides allogéniques, notamment les cellules dendritiques du thymus et des tissus, les cellules de Langerhans de l’épiderme et des Iymphocytes B.
2. Lymphocytes T
Ils ont un rôle majeur dans la réponse immunitaire cellulaire et agissent directement comme cellules effectrices. Chez l’homme, tous les Iymphocytes T expriment le récepteur CD2, mais la voie majeure d’activation Iymphocytaire T dépend de l’acquisition d’un récepteur TCR (T Cell Receptor) spécifique de l’antigène et couplé au CD3 sous la forme d’un complexe CD3/TCR à la surface cellulaire, qui rend les cellules T immunologiquement fonctionnelles. Le complexe CD3 transmet à 1’intérieur de la cellule un signal d’activation lorsque le TCR est stimulé par l’antigène.
Trente pour cent des Iymphocytes T circulants expriment le récepteur CD8, qui reconnaît les antigènes d’histocompatibilité de classe I. Deux types de lymphocytes T portent le marqueur CD8: les lymphocytes T cytotoxiques exerçant une cytotoxicité directe sur les cellules cibles sans l’intermédiaire d’une cellule présentatrice d’antigènes et les Iymphocytes T suppresseurs qui modulent l’activité des cellules B et T.
Soixante-dix pour cent des Iymphacyles T circulants expriment le marqueur CD4. Ils sont appelés Iymphocytes T auxiliaires ou « helper » et reconnaissent les antigènes d’histocompatibilité de classe II. Ils participent à la transformation des Iymphocytes B en cellules productrices d’anticorps et à la différenciation des cellules T cytotoxiques. On distingue 2 types de sous-populations Iymphocytaires CD4+ selon leur profil de sécrétion de cytokines après stimulation antigénique: 1) les CD4+ Thl sécrètent de l’interleukine 2 (IL-2), de 1’interféron gamma (IFN gamma), activent les macrophages et sont également responsables de l’hypersensibilité retardée; 2) les Iymphocytes CD4+ Th2 secrètent de l’IL-4, de 1’IL-5 et de 1’IL-10, entrament la production d’IgE, la stimulation des éosinophiles et des mastocytes. Les Iymphocytes T CD4+ Thl exercent une action inhibitrice sur les Th2 et réciproquement.
Molécules d’adhésion : les interactions cellulaires font intervenir avec l’adhésion des Iymphocytes T, différents types de cellules: les macrophages, les cellules B avec lesquelles ils coopèrent, et les cellules-cibles d’une réaction de cytotoxicité. Le CD31TCR établit une liaison spécifique avec ces différentes cellules, mais d’autres molécules ou adhésines favorisent l’adhésion en se fixant sur leurs ligands spécifiques: LFA I (Iymphocyte fanction associated antigen) avec ICAM I (inter cellular adhesion molecule), CD2 avec LFA3, CD4 avec HLA II et CD8 avec HLA I.
Les molécules d’adhésion.
Les adhésines augmentent la liaison
du récepteur des cellules T à l’antigène :

3. Lymphocytes B
Les Iymphocytes B matures expriment à leur surface des immunoglobulines IgM ou IgD, qui jouent le rôle de récepteurs spécifiques de l’antigène, et différents marqueurs de surface, dont les molécules HLA de classe I et de classe II. Après stimulation antigénique, ils proliferent en présence d’IL-4, puis se différencient en plasmocytes en présence d’IL-6. Le plasmocyte sécrète initialement des immunoglobulines de type M, de même spécificité que l’IgM de surface exprimée par le Iymphocyte B, puis lors d’une seconde stimulation antigénique (réponse secondaire) des IgG ou d’autres immunoglobulines d’isotype différent (IgA ou E) exprimant la même région variable qui caractérise la reconnaissance de l’antigène.
4. Cellules NK (natural killer) et cellules K (killer)
Les cellules NK représentent environ 2 % des lymphocytes périphériques circulants. Non restreintes par le système majeur d’histocompatibilité, elles n’adhèrent pas et ne phagocytent pas, mais peuvent reconna~tre par leur récepteur pour le fragment Fc des immunoglobulines, différentes cellules cibles recouvertes d’anticorps. Leur cytotoxicité correspond alors au phénomène de cytotoxicité dépendante des anticorps (ADCC: antibody dependent cellular cytotoxicity), à médiation cellulaire en l’absence de complément. Ces cellules sont alors appelées cellules K.
Cytokines
Les cytokines, glycoprotéines solubles, sont sécrétées par certaines sous-populations Iymphocytaires T et par les monocytes. Elles agissent à distance lors d’une réaction inflammatoire mais surtout permettent l’activation des cellules du système immunitaire (lymphocytes B, T, macrophages), des cellules responsables des réponses cytotoxiques et de celles liées à l’hypersensibilité retardée.
L’interleukine 1(IL-1), sécrétée par les monocytesmacrophages, est la première cytokine intervenant dans la maturation et l’activation des Iymphocytes B et T après contact antigénique et contrôle l’induction des récepteurs de 1’IL-2.
L’interleukine 2 (IL-2) est au centre de la réaction de rejet de greffe et représente la cible de plusieurs traitements immunosuppresseurs (ciclosporine, anticorps monoclonaux). Elle est produite par les Iymphocytes T CD4+ Thl après stimulation antigénique en présence d’IL-1. L’IL-2 n’agit que sur les Iymphocytes T activés exprimant un récepteur de haute affinité pour cette cytokine (IL-2 R). Elle stimule leur prolifération, ainsi que la production de cytokines par les lymphocytes T CD4+ et la cytotoxicité des lymphocytes T CD8+. Elle est indispensable à l’expression de l’hypersensibilité retardée. Elle stimule également la prolifération des Iymphocytes B et la production d’immunoglobulines.
L’interleukine 4 (IL-4) synthétisée par les Iymphocytes T CD4+ Th2, agit sur la prolifération des Iymphocytes B, la production d’immunoglobulines et induit l’expression des antigènes de classe II. L’IL-4 peut également agir sur les macrophages en augmentant leur cytotoxicité.
L’interleukine 6 (IL-6) synthétisée par les monocytesmacrophages et les Iymphocytes B et T, induit la prolifération des Iymphocytes B et la différenciation en plasmocytes avec production d’immunoglobulines. Elle active les Iymphocytes T, induit la différenciation des Iymphocytes cytotoxiques et des monocytes en macrophages avec augmentation de la phagocytose.
L’interféron Gamma (IFN y), produit par les Iymphocytes T activés, est un puissant activateur des macrophages. Il augmente l’expression des molécules de classe II à la surface des macrophages et des Iymphocytes B. Il augmente également l’activité des Iymphocytes cytotoxiques et des cellules NK ainsi que sa propre synthèse.
Cellules productrices des cytokines
et principales actions
| Cytokines | Cellules sécrétrices | Actions principales |
| IL-1 | Lymphocytes B et T Macrophages | Prolifération des lymphocytes T activés par l’antigène |
| IL-2 | Lymphocytes T CD4+ | Prolifération des lymphocytes T4 Différenciation en lymphocytes cytotoxiques |
| IL-4 | Lymphocytes T CD4+ | Prolifération des lymphocytes B Augmentation de l’expression du HLA II à la surface des LB |
| IL-6 | Monocytes Macrophages | Différenciation en lymphocytes cytotoxiques, différenciation des lymphocytes B en plasmocytes |
| IFN gamma | Lymphocytes T activés | Augmentation de l’expression du HLA de classe II à la surface des macrophages et des lymphocytes B |
| TNF alpha | Monocytes Macrophages Lymphocytes T | Activation et chimiotactisme des polynucléaires neutrophiles |
Antigènes exprimés par les cellules du greffon
Trois groupes d’antigènes exprimés en abondance à la surface des membranes cellulaires sont impliqués dans les mécanismes immunologiques du rejet de greffe.
1. Antigènes du complexe majeur d’histocompatibilité (CMH ou HLA)
Les gènes codant les antigènes d’histocompatibilité, qui interviennent dans l’identité du soi (HLA classe I) et le contrôle du rejet du non soi ou régulation de la réponse immune (HLA classe II), sont situés sur le bras court du chromosome 6 et réunis dans le complexe majeur d’histocompatibilité (CMH) découvert par Jean Dausset en 1958. Le typage HLA d’un individu, initialement par technique sérologique ou de microlymphotoxicité et maintenant par biologie moléculaire, permet de définir les produits géniques issus de chaque chromosome parental et donc ses 2 haplotypes. Les antigènes HLA de classe I, sont la cible de la Iymphototoxicité due aux cellules T CD8+. Les antigènes HLA de classe II, qui présentent l’antigène aux cellules T CD4+, induisent la transformation blastique des cellules T dans la réaction Iymphocytaire mixte.
Les antigènes HLA de classe I sont constitués de 2 chaînes polypeptidiques: une chaîne lourde de 45 kDa, codée dans le CMH, qui porte la variabilité et est associée de facon non covalente à une chaîne légère, codée en dehors du CMH (chromosome 5), identique pour toutes les molécules: la ß2 microglobuline. Les antigènes HLA A et B sont les principaux antigènes HLA de classe I et correspondent aux produits des 2 locus majeurs de classe I du CMH: HLA A et HLA B. Il existe un troisième locus de classe I, HLA C, situé entre HLA A et B. Les antigènes HLA C sont moins immunogéniques et, en pratique, ont une importance moindre dans les typages tissulaires réalisés. Les antigènes HLA de classe I sont exprimés par toutes les cellules nucléées de l’organisme. Les cellules lymphoides expriment beaucoup plus d’antigènes HLA de classe I que les cellules parenchymateuses. À ce jour, plus de 120 allèles de HLA classe I ont été mis en évidence. De nouveaux gènes appartenant au système HLA classe I ont été récemment mis en évidence: E, F, G, H, J et pourraient avoir un rôle dans le rejet de greffe. Les antigènes HLA de classe II sont des glycoprotéines transmembranaires, hétérodimériques comportant une chaîne a et une chaîne ß associées de manière non covalente. La région du CMH codant les antigènes de classe II, appelée HLA D, est subdivisée en 3 sous-régions: HLA DP, DQ et DR. Les antigènes HLA de classe II sont exprimés par certains types cellulaires seulement: Iymphocytes B, macrophages, cellules endothéliales et cellules dendritiques. À ce jour, plus de 150 allèles ont été mis en évidence. L’expression des antigènes HLA, notamment de classe II, est augmentée pendant le rejet. Les infections virales associées à un rejet jouent le rôle d’inducteur puissant pour l’expression des antigènes HLA par l’intermédiaire d’une sécrétion d’IFN gamma.
2. Antigènes des groupes sanguins
Système ABO: les antigènes de groupes sanguins érythrocytaires ABO sont de puissants antigènes de transplantation. Le locus ABO a 3 allèles A, B et O : gènes A et B codominants, gène O récessif avec 4 génotypes possibles (A, B, AB, O). Les antigènes A et B sont présents sur les hématies, mais aussi sur certaines cellules épithéliales et endothéliales. Des anticorps anti-A ou anti-B immuns, encore appelés allo-anticorps, peuvent apparaître à la suite d’une immunisation (grossesse, transfusions). La compatibilité dans le système ABO doit être rigoureusement respectée pour toute transplantation d’organe.
Autres systèmes antigéniques des groupes sanguins: de nombreux autres alloantigènes sont portés par les globules rouges notamment antigène Rhésus, antigènes des groupes Kell, Duffy et Kidd. À la différence des antigènes A et B, il n’existe pas d’anticorps naturels contre ces autres systèmes antigéniques érythrocytaires, qui peuvent être néanmoins responsables d’allo-immunisation. En pratique, la compatibilité dans tous ces autres systèmes antigéniques des groupes sanguins n’est pas requise pour réaliser une transplantation d’organe.
3. Antigènes mineurs d’histocompatibilité
Le rôle de certains antigènes indépendants du CMH et du système ABO dans le rejet des greffes est démontré par la survenue de rejet chez des receveurs d’allogreffe HLA identiques. La nature des antigènes mineurs d’histocompatibilité est encore mal connue. Il s’agit principalement d’antigènes exprimés par les cellules endothéliales vasculaires et par les monocytes du donneur. Les cellules endothéliales qui expriment les antigènes de classe I et II, les antigènes du système ABO sont des cibles privilégiées des réactions de rejet. Le rôle des antigènes mineurs d’histocompatibilité est variable selon l’organe greffé. L’antigène érythrocytaire Lewis et des antigènes mâles, codés par le chromosome Y, pourraient être impliqués dans le rejet de greffe d’organe et dans la maladie du greffon contre l’hôte.
Mécanisme du rejet de greffe
L’étape initiale majeure de la réaction de rejet est la reconnaissance des antigènes étrangers du greffon par les éléments du système immunitaire après présentation par les cellules présentatrices d’antigènes aux lymphocytes T CD4+ qui permet alors l’activation en cascade et la différenciation des différentes cellules du système immunitaire. L’importance relative des différents mécanismes effecteurs du rejet est difficile à apprécier, mais tous concourent à l’apparition des lésions histologiques caractéristiques du rejet d’allogreffe.
Anticorps et complément : mécanisme humoral
Les anticorps présents chez le receveur se fixent sur un antigène du greffon. Le complexe antigène-anticorps active le système du complément, avec afflux et activation des polynucléaires neutrophiles et des macrophages, aboutissant à la Iyse cellulaire qui représente l’étape finale. Ce mécanisme explique le rejet vasculaire suraigu. Les anticorps préformés après sensibilisation préalable aux alloantigènes (notamment HLA de classe I et groupes sanguin A, B, O) sont détectés par la positivité du cross match avant la transplantation (sérum du receveur mis en présence avec les Iymphocytes B et T du donneur) qui contre-indique la greffe.
Cellules T cytotoxiques
Les cellules T CD8+, en collaboration avec les cellules T CD4+ qui sécrètent de l’IL-2, détruisent les cellules du greffon par reconnaissance des antigènes HLA de classe I (ou parfois de classe II), après contact, synthèse de perforine et Iyse de la membrane de la cellule-cible, ou bien par induction d’une apoptose (mort cellulaire programmée). Ce type de rejet, fréquent, avec infiltration du greffon par des cellules mononucléées, notamment des cellules T activées, peut entraîner une fibrose mutilante.
Cytotoxicité dépendante des anticorps: ADCC
Les cellules NK sont en nombre très important dans le greffon au cours des réactions de rejet. Les cellules K du receveur se fixent, par l’intermédiaire de leur récepteur du fragment Fc, sur les cellules du greffon recouvertes d’anticorps et entraînent leur Iyse sans intervention du complément. Ce mécanisme pourrait être mis en jeu dans les lésions de vascularite observées au cours du rejet chronique.
Hypersensibilité retardée
Les Iymphocytes CD4+ reconnaissant les antigènes HLA de classe II du greffon permettent de recruter et d’activer des macrophages. Ces derniers libèrent des enzymes Iysosomiales et entraînent la Iyse de la cellule cible du greffon. Peu de Iymphocytes T sont nécessaires pour recruter un grand nombre de macrophages et entraîner des dégâts cellulaires importants.
Expression clinique du rejet d’allogreffe d’organe
Le rejet est un phénomène constant, sans périodicité, dont le diagnostic est avant tout histologique. L’expression clinique du rejet de greffe varie selon des facteurs génétiques et la nature de l’organe transplanté.
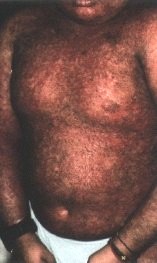 |

|
| GVH cutanée chronique (forme lichénienne) |
GVH cutanée chronique (forme scléreuse) |
Rejet suraigu
Il se manifeste dans les heures qui suivent le rétablissement de la continuité vasculaire par un infarctus du transplant, parfois associé à une coagulopathie de consommation. Des rejets suraigus peuvent survenir en l’absence d’anticorps préformés détectés par le cross match.
Rejet aigu
Il survient à partir du 4e jour après la greffe et se traduit par des signes généraux, fonctionnels et biologiques qui varient selon l’organe transplanté.
1. Après transplantation rénale
Le rejet aigu précoce plus fréquent au cours des premiers mois peut associer: fièvre, augmentation du volume ou de la sensibilité du greffon, prise de poids avec chute de la diurèse, apparition ou majoration d’une hypertension artérielle. Biologiquement, apparaissent une insuffisance rénale, une baisse de la natriurèse et parfois une protéinurie. La biopsie rénale affirme le diagnostic et apprécie la gravité et l’étendue des lésions.
2. Après transplantation cardiaque
Le rejet aigu, plus fréquent dans les 6 premiers mois, est le plus souvent asymptomatique diagnostiqué par la surveillance échographique (diminution de la contractilité segmentaire ou globale) et histologique systématiques. Les signes cliniques ou électriques, beaucoup trop tardifs, témoignent d’un rejet aigu gravissime. La biopsie endomyocardique permet d’affirmer le diagnostic et de classer le rejet selon sa gravité histologique.
3. Après transplantation pulmonaire
Le rejet reste souvent asymptomatique et est diagnostiqué par la surveillance systématique clinique, spirométrique (baisse du peak-flow et les débits distaux) et radiologique (infiltrats interstitiels parfois seulement visibles au scanner). Les biopsies transbronchiques avec lavage bronchio-alvéolaire permettent de différencier l’infection du rejet, qui peuvent coexister, et d’apprécier la sévérité histologique des lésions.
4. Après transplantation hépatique
Le rejet aigu peut être asymptomatique ou se traduire cliniquement par une asthénie, une fièvre, une hépatomégalie, une ascite ou un ictère. Souvent, seules des anomalies biologiques isolées, cholestase ou cytolyse, motivent la biopsie qui va confirmer la diagnostic.
5. Après transplantation pancréatique
La survenue du rejet pose un problème diagnostique en l’absence de marqueur précoce du rejet du pancréas endocrine. En cas de greffe combinée rein-pancréas, l’élévation de la créatininémie est considérée comme le marqueur le plus fiable du rejet pancréatique. La biopsie à l’aiguille, délicate techniquement et non dénuée de risques, reste d’interprétation difficile.
Rejet chronique
Le rejet chronique, d’étiologie multiple mais avant tout immunologique, est responsable d’une altération progressive et irréversible de la fonction du greffon. Histologiquement, il réalise une vasculopathie chronique spécifique de l’organe greffé, essentiellement fibrosante et proliférante. Les lésions d’artériosclérose accélérée du greffon diffèrent de celles de l’athérome classique, car elles sont diffuses et circonférentielles, avec hyperplasie concentrique de l’intima, respectant la limitante élastique interne et d’évolution rapide en quelques mois.
La symptomatologie du rejet chronique varie selon l’organe greffé. Après transplantation rénale, il se traduit par une insuffisance rénale lentement progressive et une hypertension artérielle parfois associées à une protéinurie. Après transplantation cardiaque, se développe une coronaropathie chronique indolore, car l’angor est asymptomatique sur un coeur dénervé. L’apparition de signes cliniques d’insuffisance cardiaque est très tardive. Après transplantation pulmonaire, apparaissent des lésions de bronchiolite oblitérante avec symptômes d’insuffisance respiratoire chronique (dyspnée, surinfection). Après transplantation hépatique, le rejet chronique se traduit par une cholestase biologique isolée, puis par un ictère progressif évoluant vers une insuffisance hépatocellulaire. Après transplantation pancréatique, réapparaissent une insulinodépendance et (ou) une insuffisance rénale en cas de transplantation rein-pancréas.
Dans tous les cas, le seul traitement du rejet chronique est la retransplantation avec un risque de récidive accrue sur le deuxième greffon. Le meilleur traitement est avant tout préventif par le diagnostic et le traitement précoces des épisodes de rejet aigus et la lutte contre les autres facteurs de risque de la maladie athéromateuse (voir: « pour approfondir » à la fin de ce document).
Mécanismes et expression clinique de la maladie du greffon contre l’hôte
Lorsque le receveur est incapable de rejeter une greffe allogénique, par déficit immunitaire pathologique ou consécutif à l’immunosuppression, et si le greffon contient des lymphocytes T, ces derniers peuvent reconnaître les antigènes du receveur et induire une réaction du greffon contre l’hôte (GVHD: graft versus host disease). La GVHD nécessite :
1) une différence d’histocompatibilité entre donneur et receveur;
2) la présence de cellules immunocompétentes dans le greffon capables de réagir contre les antigènes d’histocompatibilité de l’hôte
3) une impossibilité du receveur de rejeter la greffe.
Les mécanismes immunologiques sont incomplètement connus, mais la GVHD est liée à l’activation des lymphocytes T matures du greffon (donneur) qui reconnaissent les antigènes majeurs et mineurs différents du système HLA du receveur. L’activité cytotoxique est, soit directe par les Iymphocytes CD8+, soit indirecte par le recrutement d’autres cellules effectrices et la sécrétion de cytokines (IFN gamma, IL-1, TNF). Certains agents microbiens, notamment à partir de la flore digestive, pourraient avoir une antigénicité croisée avec des alloantigènes de l’hôte ou causer une activation non spécifique des macrophages ou des cellules présentatrices d’antigènes.
GVHD aiguë
Elle survient généralement dans les 100 jours suivant la greffe, la plupart du temps entre 2 et 5 semaines, avec une fréquence de 30 à 70 % selon la greffe considérée malgré le traitement préventif. Les trois organes cibles sont: la peau, le foie et le tube digestif. La GVHD aiguë est classée en 4 grades de gravité croissante, selon le degré d’atteinte des 3 organes-cibles et avec altération plus ou moins marquée de l’état général: grades I et II de pronostic favorable, grade III de pronostic réservé, grade IV presque toujours mortel.
Score clinique de sévérité de l’atteinte des
organes-cibles au cours de la GVHD aiguë
Peau
| Sévérité | Peau |
| + | Eruption < 25% Surface Corporelle |
| ++ | Eruption 25-50% Surface Corporelle |
| +++ | Eruption généralisée |
| ++++ | Epidermolyse bulleuse |
Foie
| Sévérité | Foie |
| + | Bilirubine : 10-30 mg/l |
| ++ | Bilirubine : 30-60 mg/l |
| +++ | Bilirubine : 60-150 mg/l |
| ++++ | Bilirubine : > 150 mg/l |
Tube digestif
| Sévérité | Tube Digestif |
| + | Diarrhée > 500 ml/24h |
| ++ | Diarrhée > 1000 ml/24h |
| +++ | Diarrhée > 1500 ml/24h |
| ++++ | Douleurs abdominales sévères ou hémorragies |
Grades de sévérité de la GVHD aiguë
| Grade | Peau | Foie | Tube Digestif | Altération de l’état général |
| I | + à ++ | 0 | 0 | 0 |
| II | + à +++ | + | + | Discrète |
| III | ++ à +++ | > ++ | > ++ | Marquée |
| IV | >=++ | >=++ | >=++ | Sévère |
1. Peau
Il s’agit d’une éruption maculopapuleuse, prurigineuse, inflammatoire, d’évolution fluctuante, touchant le visage, la paume des mains et la plante des pieds, douloureuse dans les deux derniers territoires. Elle peut s’étendre au tronc, à la racine des membres puis à l’ensemble du tégument. Toutes les formes sont possibles depuis l’éruption localisée jusqu’au syndrome de Lyell. Les muqueuses peuvent être atteintes (conjonctive, organes génitaux externes). Le diagnostic de certitude est histologique: foyers de nécrose, vacuolisation des cellules basales de l’épiderme, oedème et infiltration du sous-épiderme et habituellement mais inconstamment en immunomarquage, des Iymphocytes T CD8+.
2. Tube digestif
L’atteinte du tube digestif est souvent retardée. Elle s’exprime typiquement par une diarrhée à quantifier, avec douleurs abdominales et vomissements. Des hémorragies digestives sont possibles. En cas d’atteinte colique basse, un syndrome rectal peut être au premier plan. Les biopsies, rarement indiquées, peuvent révéler une atrophie villositaire, une destruction des cryptes intestinales et une infiltration Iymphocytaire de la lamina propria.
3. Foie
L’atteinte hépatique se traduit par un ictère d’intensité variable, avec cytolyse initiale régressant progressivement alors que se développe une cholestase sans insuffisance hépatocellulaire. L’histologie retrouve des foyers de nécrose éosinophile, une destruction des canaux biliaires, une hypertrophie des cellules de Küpffer et des infiltrats lymphocytaires péribiliaires. Elle est indispensable au pronostic et guide le traitement.
GVHD chronique
Par définition, la GHVD chronique, généralement mais non constamment précédée par une GVHD aiguë, apparaît plus de 100 jours après la greffe, mais ses manifestations peuvent être plus précoces. Elle survient chez environ 50 % des patients et atteint, à des degrés variables, la peau, les muqueuses et le foie. Elle est classée en formes limitées [peau et (ou) maladies hépatiques] ou extensives. La symptomatologie de la GVHD chronique évoque certaines maladies systémiques, dites « auto-immunes » (sclérodermie, syndrome de Gougerot-Sjögren ou cirrhose biliaire primitive). La GVHD chronique entraîne la persistance d’un déficit immunitaire responsable d’infections tardives potentiellement mortelles (infections à CMV, aspergillose).
1. Peau et muqueuses
L’atteinte cutanée est quasi constante avec des zones d’hyper ou d’hypopigmentation, planes (type lichen plan) ou associées à des papules, avec des formes lichéniennes ou scléreuses. Il peut s’agir d’une éruption érythémateuse diffuse avec desquamation survenant après exposition solaire, sur un territoire irradié ou sur des lésions infectieuses (zona). L’atteinte muqueuse entraîne un syndrome sec buccal et oculaire de type syndrome de Gougerot-Sjögren. Histologiquement, existent une nécrose épithéliale, un infiltrat mononucléé riche en cellules CD8+ et une fibrose épithéliale et sous-épithéliale.
2. Foie
L’atteinte hépatique, très fréquente (95 % des cas), se traduit par une cytolyse hépatique d’intensité variable et une cholestase parfois responsable d’un ictère. Elle peut mimer une cirrhose biliaire primitive. Le diagnostic est surtout histologique: atteinte des canaux biliaires majeure avec parfois leur destruction complète, infiltrats inflammatoires péribiliaires avec différenciation plasmocytaire et destruction hépatocytaire au contact des lymphocytes.
3. Autres manifestations
La GVHD chronique s’accompagne de l’apparition d’autoanticorps dans 10 à 60 % des cas: anticorps antinucléaires, anticorps anti-DNA et anti-muscle lisse, plus récemment anticorps anticytosquelette et antinucléolaires. Des tableaux évolués peuvent être observés avec différentes atteintes évocatrices d’une maladie systématique proche de la sclérodermie. L’atteinte oculaire, parfois asymptomatique dépistée par le test de Shirmer, est caractérisée par une kérato-conjonctivite sèche avec irritation et photophobie. L’atteinte pulmonaire grave réalise un tableau de bronchiolite oblitérante avec pneumopathie obstructive résistante aux bronchodilatateurs, qui assombrit le pronostic vital. L’atteinte digestive est rare au cours de la GVHD chronique, mais peut entrâîner des troubles de la motricité oesophagienne. Des neuropathies périphériques, polymyosites voire myasthénies sont possibles. Les arthropathies sont secondaires aux rétractions tendineuses et à l’amyotrophie d’origine mixte, spécifique lice à la GVHD, et cortisonique.
Points Forts à Retenir
Les manifestations cliniques du rejet d’allogreffe sont tardives après transplantations d’organes et le diagnostic de rejet aigu repose avant tout sur l’histologie du greffon.
Dans la forme aiguë de la GVHD, les organes cibles sont : la peau, le foie et le tube digestif.
Dans la forme chronique de la GVHD, les organes-cibles principaux sont la peau et le foie. Les manifestations cliniques et biologiques peuvent prendre l’aspect de maladies systémiques telles qu’un syndrome de Gougerot-Sjögren, une sclérodermie ou une cirrhose biliaire primitive.
Pour approfondir…
« Principe de traitement du rejet aigu du greffon après transplantation d’organe »
Il dépend de la sévérité et de la nature de l’organe transplanté et repose classiquement sur une corticothérapie à forte dose en bolus intraveineux pendant 3 jours. L’efficacité du traitement est jugée rapidement sur la régression des signes cliniques ou biologiques, échograpaiques ou radiologiques et (ou) sur les résultats d’une biopsie de contrôle. En cas d’échec, un traitement immunosuppresseur plus important par répétition des bolus de corticoïdes intraveineux seuls ou associés à une cure de 3 à 10 jours de sérum anti-lymphocytaire poly ou monoclonal, parfois suivi d’une augmentation de la corticothérapie per os à la dose de 1 mg/kg par jour avec décroissance secondaire, permet en règle générale de contrôler le rejet. Les rejets suraigus irréversibles sont extrêmement rares et surviennent soit très précocement soit en cas de retard diagnostique. La prévention du rejet aigu repose sur le maintien du traitement immunosuppresseur de fond et l’acquisition progressive d’une tolérance du greffon.
Sympa: accès direct
=http://www.medicalistes.org/wws/
Mécanismes du Rejet d’Allogreffe
- Auteur : B. CHARPENTIER
- Ouvrage: Traité de Médecine (3ème édition), éd. Flammarion
- Date de publication: septembre 1996
Nous sommes conscients que cet article est relativement ancien; toutefois, il renferme des renseignements qui vous seront sans doute utiles; aussi l’avons-nous laissé en ligne. Par ailleurs, si vous disposiez d’articles plus récents sur le même sujet, n’hésitez pas à nous en faire part afin de demander leur autorisation à leurs auteurs pour une publication en ligne sur ce site
Depuis les premieres descriptions cliniques du rejet aigu d’allogreffe, il y a une trentaine d’annees, ce probleme qui semblait irreversible et incontournable a beaucoup evolue. A l’heure actuelle, le rejet aigu d’allogreffe precoce est le plus souvent controle en augmentant l’immunosuppression; souvent ecrete, il passe inaper,cu et est difficile a distinguer des autres causes de dysfonction d’organe. Pourtant, toute transplantation implique une reconnaissance allogenique chez le receveur, donc un mecanisme immunologique beaucoup plus complexe qu’une simple reponse a un antigene soluble. D’un point de vue d’immunologie fondamentale, la transplantation d’organe ne devrait pas reussir, tant sont << fortes >> les barrieres d’histocompatibilite et tant est grande la frequence des Iymphocytes precurseurs alloreactifs. Et pourtant, la transplantation d’organes est une therapeutique efficace, avec des survies d’allogreffe de 😯 a 90p.1OO a un an.
Il y a une vingtaine d’annees, Medawar demontrait que, chez le lapin, une greffe de peau provenant d’un autre lapin etait rejetee par un mecanisme actif avec une memoire et un rejet accelere et specifique des allogreffes secondaires. Plus tard, Medawar, Brent et Billingham montraient que des animaux rendus tolerants, a leur naissance, par l’injection de cellules allogeniques, ne rejetaient pas les greffes de peau du meme donneur. Ce double concept de rejet et de tolerance continue, en grande partie, a gouverner l’immunologie de transplantation, mais la complexite de ces deux phenomenes reste telle que leur elucidation complete est encore lointaine [1, 5].
ASPECTS MORPHOLOGIQUES ET FONCTIONNELS
DU REJET D’ALLOGREFFE
Greffes de peau
Une autogreffe ou une greffe syngenique de peau est rapidement vascularisee des les 2-3 premiers jours et a un aspect normal aux 4e-5e jours; I’architecture de la peau est conservee avec seuls quelques infiltrats de cellules inflammatoires dues au traumatisme chirurgical.
Une allogreffe primaire entre deux individus genetiquement differents d’une meme espece a un comportement initial analogue a l’autogreffe avec retablissement vasculaire, mais tres rapidement s’installe une infiltration perivasculaire de Iymphocytes, Iymphoblastes, plasmocytes et macrophages. Vers le 7e jour, la greffe commence a se necroser, a s’epaissir avec necrose totale et ob*struction de la vascularisation vers le 10ème jour. Le greffon est elimine, faisant place a une cicatrice. Une difference d’histocompatibilite entre donneur et receveur accelere ce processus si elle est tres forte, le retarde parfois sur plusieurs semaines si elle est faible, donnant alors l’aspect trompeur d’une greffe toleree tandis qu’un rejet chronique peut etre demontre sur une biopsie.
Les allogreffes secondaires effectuees a distance (semaines ou mois) d’une premiere greffe sont rejetees de fa,con acceleree. L’evolution dans les 3 ou 4 premiers jours est identique a celle de la greffe primaire, hormis le cas precis du rejet hyperaigu du a des anticorps preformes. Mais des que la vascularisation de la greffe s’etablit, le rejet intense detruit le greffon entre le 5e et le 7e jour. Fait essentiel, le rejet secondaire est specifique des antigenes d’histocompatibilité du premier donneur; une deuxieme greffe d’un donneur non lie genetiquement au premier ne subit pas de rejet accelere.
Greffes d’organes
Le destin des greffes d’organes allogeniques est fondamentalement le meme que celui des greffes de peau, mais les modalites du rejet different d’un organe a l’autre, la peau etant le tissu le plus rapidement rejete [2].
Le rejet aigu d’allogreffe renale [8] debute entre le 4e et le 6e jour posttransplantation, avec infiltration de l’interstitium renal par des cellules mononucleees (Iymphocytes, monocytes, macrophages) et _dème parfois tres important. Arterioles et glomerules sont initialement normaux mais, si le rejet continue a evoluer, des lestons arteriolaires (agregats de plaquettes, de fibrine et prol i ferati on intimale) et glomerulaire s (i schemie glomerulaire , fibrose) apparaissent. Dans les rejets chroniques, I’infiltrat cellulaire inflammatoire est generalement modere; par contre la fibrose interstitielle est extensive, avec proliferation de l’intima et de la media des vaisseaux de moyen et petit calibres et lestons des glomerules aboutissant a leur destruction.
En clinique, le rejet des greffes d’organe se traduit par la perte progressive des fonctions des greffons: montee de la creatininemie et chute de la natriurese pour le rein; alteration de la fonction myocardique pour le cceur; elevation de la bilirubine, des transaminases pour le foie; hyperglycemie pour le pancreas; anomalies radiologiques et fonctionnelles respiratoires pour les poumons.
Les rejets secondaires d’organes se traduisent par un rejet accelere ou meme hyperaigu de type humoral. Ce dernier entrame une necrose typique du greffon dans les minutes ou les heures suivant la transplantation.
Cas particuliers
Sites privilegies Certaines allogreffes ne subissent pas de rejet lorsque le greffon est implante dans un site peu accessible aux Iymphocytes du systeme immunitaire (chambre anterieure de l’ceil. tissu cerebral, poche jugale du hamster).
Tissus privilegies Certains tissus peu ou pas vascularises, tel le cartilage, resistent au phenomene du rejet.
Xenogreffes Leur destin depend de l’etendue des differences entre donneur et receveur, avec des especes concordantes et discordantes. La plupart sont rapidement rejetees, parfois de fac,on hyperaigue, si le receveur possede des anticorps naturels anti-espèce du donneur.
La reaction du GVH (graft versus host ou greffon contre l’hote) peut etre consideree comme l’inverse ou le symetrique de la reaction de rejet. Le greffon developpe une reaction de rejet contre l’hote, lui-meme incapable de rejeter le greffon. Pour que cette reaction se developpe, essentiellement au cours de la greffe de moelle, il faut que les cellules greffees soient immunocompetentes (en general des Iymphocytes T) et que l’hote soit immunoincompetent pour des raisons immunologiques (irradiation, drogues immunosuppressives) ou genetiques (injection de cellules parentales a un hybride Fl).
ASPECT IMMUNOLOGIQUE DU REJET D’ALLOGREFFE
Au cours du rejet de greffe, des modifications interviennent au niveau local, c’est-a-dire le greffon, mais aussi regional (ganglions drainant le territoire de la greffe) et enfin systemique.
Au niveau du greffon
Il existe une reaction de type inflammatoire avec nombreux infiltrats perivasculaires de Iymphocytes T actives, monocytes et Iymphocytes B. Ces cellules sont capables de proliferer en presence des cellules du donneur in vitro et de les Iyser par une reaction de cytotoxicite a mediation Iymphocytaire. Un double flux cellulaire existe en sens inverse entre greffe et hote. La greffe est rapidement envahie par des cellules immunocompetentes de << phenotype receveur >> dans les aires perivasculaires, en particulier au niveau des capillaires veineux, phenomene connu depuis de nombreuses annees. Ce processus necessite la presence sur l’endothelium vasculaire et sur les cellules immunitaires de molecules complementaires d’adhesion, dont le role est fondamental pour la margination et la diapedese. L’efflux de cellules dendritiques de << phenotype donneur >>, emigrant de la greffe pour se localiser dans la rate du receveur ou elles vont etre identifiables 6 jours avant de devenir indetectables, a ete demontre recemment. Ce processus de double trafic peut etre rapproche d’un microchimerisme temporaire [4]. Un cedeme du tissu interstitiel est generalement associe, du a la production de substances solubles inflammatoires de type cytokines-lymphokines qui joueront un r61e dans l’attraction de cellules phagocytaires. Les principales cytokines, synthetis es a la phase precoce par les monocytes-macrophages, suite a la presentation de l’antigene sont l’lLI et l’lL6, fondamentales pour 1’immunocompetence des Iymphocytes T. En retour, afin d’amplifier nettement cette reponse, sont synthetises l’interferon gamma par les Iymphocytes T et le TNF (tumor necrosis factor) par les monocytes et les Iymphocytes T.
Au niveau des organes lymphoïdes
Les ganglions regionaux d’une greffe augmentent rapidement de volume, avec hypertrophie des zones paracorticales, presence de Iymphoblastes tres jeunes des les 2e-3e jours et augmentation du debit des Iymphatiques afferents et efferents. Des cellules transformees (Iymphoblastes) peuvent etre presentes dans le sang peripherique.
Cellules effectrices
Cellules T CD3 De nombreuses cellules sont impliquees dans le rejet d’allogreffe, mais les Iymphocytes T CD3+ ont un r61e predominant [3, 6, 7], et parmi eux :
les Iymphocytes T cytotoxiques (Tc , CD 8+) reconnais sent les antigenes d’histocompatibilité de classe I et possedent une cytotoxicite directe sur la cellule cible. Une cellule effectrice peut detruire successivement plusieurs cellules cibles portant le meme antigene. La molecule CD8 se lie plus specifiquement au domaine alpha 3 des molecules de classe I;
les Iymphocytes T auxiliaires (Th, CD4+) reconnaissent les antigenes de classe 11. La molecule CD4 se lie a la portion juxtamembranaire des molecules de classe II.
Le rôle respectif des cellules CD4+ et CD8+ dans 1’allodestruction reste debattu. Des les annees SO, pour Brent et Medawar, I’immunite antigreffe s’apparentait a un phenomene d’hypersensibilite retardee (due a des cellules T auxiliaires ou CD4+), alors que tout suggerait un r61e fondamental des cellules T cytotoxiques classiques. L’importance experimentale de la mediation du rejet par hypersensibilite retardee a ete montree par plusieurs groupes. Actuellement, cytotoxicite et hypersensibilite retardee sont les deux mecanismes impliques dans le rejet, chacun etant en fait recrute par la qualite de la cible a reconnaitre, puis a detruire.
L’utilisation d’anticorps monoclonaux murins ami-sous-populations Iymphocytaires a permis de caracteriser sur coupes biopsiques les cellules infiltrant le greffon. Les cellules T representent la sous-population Iymphocytaire la plus abondante, avec un rapport cellules CD8+/CD4+ significativement augmente par rapport aux contr61es, sans aucune difference du nombre de Iymphocytes B et de monocytes- macrophages. L’analyse des cellules infiltrant les greffons est maintenant une technique de routine dans certaines equipes de transplantation.
Role des cellules naturelles tueuses, Iymphocytes NK (natura/ killerl, dans le systeme de cytotoxicite dependante des anticorps ADCC (antibody dependent cellular cytotoxicityl Parmi les Iymphocytes envahissant le greffon tres precocement, les LGL (large granular Iymphocytes), tres proches des Iymphocytes NK, voire identiques, sont en proportion tres abondante. Sur le plan experimental, les LGL ont un pic vers le 4e jour et decroissent ensuite. Les LGL sont aussi presents dans les autogreffes ou la reaction inflammatoire est constituee de Iymphocytes et de monocytes sans cellules Iymphoblastiques. Le r61e des cellules NK est discute [9], d’autant que la fonction NK des Iymphocytes peripheriques augmente au cours du rejet, sans doute secondairement a la secretion d’interféron et d’lL2. Une activite cytotoxique de type ADCC est souvent mise en evidence au sein des cellules du greffon, en testant soit les anticorps peripheriques, soit les anticorps fixes aux structures du greffon, et pourrait etre impliquee dans les mecanismes du rejet.
Role des Iymphocytes B et des macrophages Une proportion non negligeable de Iymphocytes B est generalement mise en evidence au cours du rejet aigu (20 30 p. I OO du total de l’infiltrat) et leur r61e exact reste meconnu. La presence des plasmocytes secretant des immunoglobulines in situ demontre une maturation locale de ces cellules. Des Iymphocytes B contenant des IgG et des IgM peuvent etre mis en evidence tres t6t dans le rejet de greffe renale, mais ils disparaissent rapidement et tres peu finalement secretent des immunoglobulines. La speecificite de ces immunoglobulines reste a determiner, et il pourrait ne s’agir que d’une activation polyclonale faisant suite a une importante activation T.
Le systeme monocytaire-macrophagique represente aussi une portion non negligeable des cellules infiltrant le greffon au stade precoce: IOp.lOO entransplantation experimentale, et dans une etude de Hancock sur des greffes de rein chez l’homme, 38 p. IOO de la population en cas de rejet modere, mais plus de 60 p. 100 en cas de rejet sévère Ce systeme a un r61e important dans la presentation et la reconnaissance des allo- antigenes, la synthese d’ILI, d’lL6 et de TNF, I’amplification de l’inflammation et dans la cytodestruction directe ou indirecte.
Implications des Iymphokines dans le rejet
Les Iymphokines, secretees par certaines sous-populations Iymphocytaires T et monocytaires, ont un r61e majeur dans la reponse allogenique [IO]: I’ILI, I’IL6, I’interferon gamma, le TNF et surtout l’lL2 ont pris une place prepondeerante dans l’initiation de la reponse immune d’allogreffe. L’IL2 a un r61e capital de meediateur soluble relargue par des sous-populations T activees, agissant comme second signal sur les Iymphocytes T cytotoxiques. L’IL2 peut dans certaines conditions restaurer l’alloreactivite. En transplantation renale humaine, une secretion importante d’lL2 est contemporaine des crises de rejet aigu. Chez le rat sous ciclosporine, le rejet est associe a une secretion importante d’lL2, alors que la tolerance est associee a celle d’lL3. L’implication des Iymphokines dans l’induction du rejet, et eventuellement de la tolerance, est renforcee par d’autres arguments indirects: par exemple, I’administration d’anticorps monoclonaux diriges contre la chatne alpha de 55 kDa du recepteur de l’lL2 (antigene TAC) prolonge la survie des allogreffes de c_ur chez les rongeurs.
La technique d’HIS (hybridation in situ) permet d’etudier la production de cytokines par les populations immunitaires infiltrant le greffon et l’importance probable de l’lL6 dans 1’initiation des phenomenes de rejet: I’augmentation de la synthese d’ARNm de l’IL6 est tres importante en cas de rejet aigu, alors que l’ARNm de l’interferon alpha n’est pas detecte; dans des greffons a fonction renale normale, aucun signal correspondant a ces Iymphokines n’est detecte.
Analyse clonale du repertoire des Iymphocytes actives in vivo par les allo-antigenes
L’etude du rejet par les techniques sus-citees est une approche » polyclonale >> de l’ensemble des sous-populations cellulaires associees au rejet, dont certaines ne sont qu’accompagnatrices, voire accessoires. Or, tout phenomene de rejet implique l’idee d’une expansion clonale, et donc specifique, d’un tout petit nombre de cellules T, voire d’une seule cellule T, les autres cellules etant recrutees de fa,con non specifique. La theorie de Burnett predit que tout individu possede un repertoire specifique contre tous les allodeterminants qui peuvent lui etre presentes. En pratique, certaines equipes de recherche, en particulier du centre universitaire de Nantes, ont developpe des clones a partir de cellules infiltrant une allogreffe renale rejetee, « race a une technique de dilution limite des cellules, en obtenant une seule cellule par puits de culture Cette cellule est ensuite stimulee par les cellules du donneur et des facteurs de croissance Iymphocytaire (IL2) permettent sa proliferation. Schematiquement, toutes les cellules ainsi obtenues sont d’origine T (T3+, Tl 1+): la moitiee de phenotype T auxiliaire (T4+), I’autre moisie de phenotype suppresseud cytotoxique (CD8+). Tous les clones CD8+ sont cytotoxiques contre les cellules du donneur. Cette approche de l’analyse clonale des cellules effectrices du rejet permet aussi de demontrer in vivo l’efficacite de ces cellules. Ainsi, I’injection chez la souris de clones de CD8+, diriges contre 1’antigene mineur d’histocompatibilite Epal et restreints par le complexe majeur d’histocompatibilité H-2KK, permet d’entrainer un rejet local de peau, de reconnaitre de fa,con specif fique l’antigene mineur Epal, de ne pas recruter de cellules provenant de l’hôte et d’avoir un effet dose-cependant tout a fait direct.
Analyse du recepteur des Iymphocytes T pour les allo-antigenes
L’utilisation d’anticorps monoclonaux et de clones de cellules T a permis de montrer que le recepteur T est constitue de 2 sou.s-unites fonctionnelles, Ti et CD3, comprenant elles-memes plusieurs sous-unites. Ti alpha et Ti beta pour Ti sont lieees entre elles par un pont disulfure et associees de fa,con non covalente au complexe CD3, lui-meme constitue de plusieurs chames. Dans le systeme de reconnaissance des Iymphocytes T, la molecule CD4 reconnais les molecules d’histocompatibilite de classe 11, la molecule CD8 reconnais telles de classe 1. Puisque le recepteur T est le pivot fondamental de la reconnaissance et de la fonction effectrice Tc dans une reaction de Iyse, spécifique ou non specifique, il est theoriquement possible d’inhiber la reaction de rejet par l’intermediaire d’anticorps diriges contre le recepteur Ti ou contre le récepteur T3. L’inhibition des sous-unites Ti est encore au stade de manipulation in vitro, alors que l’ethcacite des anticorps monoclonaux anti-T3 a ete amplement prouvee en transplantation clinique.
CIBLES DU REJET D’ALLOGREFFE
Les antigenes d’histocompatibilite representent la cible majeure de la reac ion immunitaire. Ce sont principalement les produits des genes du complexe majeur d’histocompatibilité, mais les produits codes par les systemes mineurs, ainsi que certains produits specifiques d’organes (systeme Epa pour la peau, par exemple), peuvent jouer un r61e non negligeable dans certains rejets tardifs. Le r61e d’antigenes << prives >> d’organes n’est pas tres clair, et dans une suite de travaux importants, Hart et Fabre ont montre que 😯 p. IOO des anticorps produits chez le rat apres injection d’homogenat de rein etaient diriges contre les antigenes speecifiques du rein, dont a peu pres la ml itie contre les allo- antigenes specifiques du rein. L’allo-antigene specifique du rein n’etait pas code par un locus du systeme majeur d’histocompatibilite et n’induisait pas de lesion de rejet. Cet antigene etait localise au niveau des membranes basales du tube contourne proximal et a quelques-unes des capsules de Bowman. Des resultats semblables ont ete obtenus par ce groupe dans des systemes d’immunisation de foie et de c_ur En revanche, des antigenes localises au niveau de l’endothelium vasculaire (E) peuvent etre fortement antigeniques et vulnerables lors du rejet d’allogreffe renale. Des anticorps anti-E ont ete detectes dans le serum d’a peu pres 50 p. IOO des malades presentant un rejet irreversible, et ont ete eludes a partir des greffons reje tes. Les antigenes du groupe E sont expnmes sur les monocytes et les granuleux et non sur les Iymphocytes non stimules, sur les plaquettes et les globules rouges. Cet antigene est present sur l’endothélium vasculaire des capillaires peritubulaires, sur les glomerules et les arteres de moyen calibre.
Les antigenes mineurs de transplantation peuvent servir de cibles importantes en transplantation d’organe. Parmi eux, le systeme H-Y a peut- etre un rôle dans le rejet d’allogreffe chez l’homme. Experimentalement, la reponse immunitaire au systeme H-Y est un exemple typique de reponse T importante, qui se manifeste par un rejet d’allogreffe, la generation de cellules I c, une reaction d’hypersensibilité retardee tandis que la reponse humorale est faible. La reponse T inclut differentes sous-populations Iymphocytaires T, dont l’activation est contrôlée par des genes de reponse immune (Ir) localises dans la region K/D ainsi que dans les sous-ragions IA et IE du complexe majeur d’histocompatibilité de la souris; le contr61e pourrait etre assure aussi par des genes Ir non lies au H-2 qui ne sont pas encore definis. De plus, des antigenes de classes I et II sont necessaires pour la reponse, car ils doivent etre associes a l’antigene H-Y pour que celui-ci soit reconnu par les cellules Th et Tc. L’influence deletere du systeme H-Y a ete deemontree en greffe de moelle et de rein chez l’homme.
MODELES D’ETUDE IN VITRO DE LA RÉACTION DE REJET DE L’ALLOGREFFE
Reaction Iymphocytaire mixte (MLR)
C’est un test de reconnaissance des allo-antigenes et de proliferation. Mis en presence et cultives in vitro, les Iymphocytes de deux individus genetiquement differents se transforment et proliferent. Si la proliferation de l’une des deux populations est inhibee par la mitomycine ou l’irradiation, elle est uniquement stimulante. La deuxieme population par contre prolifere. Cette proliferation, quantifiee par l’incorporation de thymidine marquee, est liee a la stimulation par les antigenes d’histocompatibilite de classe II (DR, DP, DQ) de la population stimulante. En cas d’identite a ces loci (jumeaux, individus classe II identiques) aucune proliferation n’apparaît Parmi les Iymphocytes qui proliferent, les Iymphocytes T auxiliaires, T suppresseurs, T cytotoxiques predominent avec secretion de Iymphokines et differenciation de cellules memoires.
Lymphocytotoxicite a mediation cellulaire ICML
Cette reaction met en evidence la phase effectrice de la reponse allogen lue developpee au cours de la CML. Elle permet d’etudier la Iyse specifique de la population repondeuse vis-a-vis de la population stimulante utilisee egalement comme cible de la Iyse. Cette cible est representee par les Iymphocytes, transformes par des mitogenes et marques par un produit radioactif comme le chrome Sl relargue par les cellules detruites. Les antigenes cibles de cette Iyse sont principalement les antigenes d’histocompatibilite de classe I.
CONCLUSION
Il est devenu evident de considerer le rejet d’allogreffe comme eminemment complexe, la notion meme d’alloreactivite ne venant que recemment d’etre mieux comprise, tant par la presentation antigenique par les molecules du CMH (complexe majeur d’histocompatibilite) que par le repertoire du recepteur des Iymphocytes T.
Dans la plupart des circonstances, les Iymphocytes T CD3+ CD4+ et CD3+ CD8+ et les macrophages sont les constituants majeurs de 1’infiltrat cellulaire in situ. Mais cet infiltrat est loin d’etre totalement specifique vis-a-vis de l’histocompatibilite du donneur, car de nombreux mediateurs solubles sont potentiellement secretes localement. Parmi les plus importants, I’ILI, I’IL2, I’IL6, le TNF gamma, I’IL5,…, ont une action de differenciation cellulaire et de proliferation depassant largement le compartiment des cellules immunitaires, specifiques ou non de la reponse allogenique. Des mecanismes immunoregulateurs peuvent contr61er cette reponse allogenique, mais sont encore peu definis in vivo et pourraient etre preferentiellement expandus lors de tentatives d’induction de tolerance specifique. Certains de ces circuits (CD4+, CD8+) peuvent d’ailleurs etre confondus avec les mecanismes du rejet observes in situ.
BIBLIOGRAPHIE
- 1. BENICHOU G, TAKIZAWA PA, oLSON CA et al. Donor major histocompatibility complex (MHC) peptides are presented by recipient MHC molecules during graft rejection. J Exp Med, 1992, 175: 3OS-3O8.
- 2. CHARPENTIER B. Mechanisme of rejection. Transplant Proc, 1983, 15: 259-263.
- 3. KOURILSLKY P. CLAVERIE JM. MHC-antigen interaction: what does the T cell receptor see ? Adv Immunol, 1989, 45: IO7-193.
- 4. LARSEN CP, MORRIS PJ, AUSTYN JM. Migration of dendritic leukocytes from cardiac allograft into host spleens. J Exp Med, 1990, 171: 3()7-314.
- 5. LECHLER Rl, LOMBARDI G. BATCHELOR JR et al. The molecular basis of alloreactivity. Immunoi Today, 199O, 11: 83-88.
- 6. MATIS LA. The molecular basis of T-cell specificity. Ann Rev Immunol, 199(). 8:65-82.
- 7. PANINA-BORDIGNON P, CORRADIN G, ROOSNEK E et al. Recognition by class 11 alloreactive T cells of processed determinants from human serum proteins. Sciences, 1991, 252: IS48-155O.
- 8. PLATT JL, LEBIEN TW, MIC CHAEL AK. Interstitial mononuclear cell population in renal graft rejection. Identification by monoclonal antibodies in tissue sections. J Exp Med, 1982, 155: 17-3O.
- 9. ROTZCHKE o, FALK K. Naturally occuring peptide antigens derived from the MHC class-I restricted processing pathway. Immunol Today, 1991, 12: 447- 455.
- IO. VANDENsRoEKE C, CAILLAT-ZUCMAN S, LEGENDRE C et al. Differential in situ expression of cytokines in renal allograft rejection. Transplantation, 1991, 5/: 6O2-6O9.
Greffe de Moëlle Allogénique
-* Auteurs : P. RIBAUD ET E. GLUCKMAN
- Ouvrage: Traité de Médecine (3ème édition), éd. Flammarion
- Date de publication: septembre 1996
Nous sommes conscients que cet article est relativement ancien; toutefois, il renferme des renseignements qui vous seront sans doute utiles; aussi l’avons-nous laissé en ligne. Par ailleurs, si vous disposiez d’articles plus récents sur le même sujet, n’hésitez pas à nous en faire part afin de demander leur autorisation à leurs auteurs pour une publication en ligne sur ce site
- Résultats selon l’indication
- Leucémies aiguës myéloblastiques (LAM)
- Leucémies aiguës lymphoblastiques (LAL)
- Leucémies myéloïdes chroniques (LMC)
- Autres hémopathies malignes
- Aplasies médullaires
- Autres indications
- Conclusion
La greffe de moelle allogénique permet de remplacer le tissu hématopoïétique anormal d’un patient par le tissu hématopoïétique sain d’un donneur. Dans le monde, plus de 20 000 cas ont été enregistrés. En France, 600 allogreffes, dont 90 p. l00 à partir d’un donneur géno-identique, sont actuellement pratiquées par an dans 37 centres. La SFGM (Société française de greffe de moelle) collige et analyse l’ensemble des observations.
INDICATIONS
La greffe de moelle est largement reconnue dans le traitement de certaines affections, malignes ou non, du système hématopoïétique. Les leucémies représentent 70 p. l00, des indications, les Iymphomes et myélomes l0 p. l00 les aplasies médullaires 7p.l00 et les maladies héréditaires le reste. Pour chaque maladie, l’indication de greffe est posée lorsqu’il n’y a pas d’alternative thérapeutique curatrice. Compte tenu de la toxicité de ce traitement, l’âge du malade ne peut dépasser 55-60 ans.
BILAN AVANT GREFFE
Chez le donneur, ce bilan élimine une contre-indication à l’anesthésie, vérifie la normalité des valeurs hématologiques , précise le phénotype érythrocytaire et le statut sérologique viral (HBV, HCV, CMV, EBV, HTLV1, VIH1 et VIH2). Par ailleurs, un prélèvement pour autotransfusion est fait 2 à 4 semaines avant la greffe. Dans le cas d’un donneur familial, selon la loi Caillavet, il suffit pour un donneur adulte de donner un consentement écrit; pour un donneur mineur, il faut l’autorisation des parents et un accord de trois experts désignés par le Préfet. Chez le receveur, ce bilan, effectué avant l’hospitalisation, est approfondi: antécédents médicaux personnels et familiaux, fonction des organes, sérologies virales, maladie hématologique, dépistage et traitement de tout foyer infectieux potentiel. Sérums et lymphocytes du donneur et du receveur sont prélevés et congelés pour vérifier ultérieurement le chimérisme postgreffe.
TECHNIQUE OPERATOIRE
Avant l’entrée du patient en secteur stérile, un cathéter central tunnellisé est placé au bloc opératoire avec une aseptie rigoureuse.
Hospitalisation, conditionnement, greffe
Le malade est hospitalisé l5 jours avant la date de la greffe, dite jour 0. La décontamination digestive et les différentes prophylaxies médicamenteuses sont mises en route. Le conditionnement est débuté 8 à l0 jours avant le jour 0 afin d’éviter le rejet de greffe et d’éradiquer d’éventuelles cellules tumorales/leucémiques résiduelles. Classiquement, il consiste en l’association d’une TBI (total body irradiation, irradiation corporelle totale) et de cyclophosphamide, avec de nombreuses variantes selon l’indication de la greffe et les protocoles locaux. La recherche d’une meilleure activité antileucémique et d’une moindre toxicité a conduit depuis une dizaine d’années à utiliser aussi des conditionnements purement chimiques comprenant alors toujours du busulfan. D,autres médicaments (étoposide, melphalan et cytosine arabinoside) sont couramment associés à la TBI ou au busulfan. Le prélèvement de moelle se fait sous anesthésie générale par ponction-aspiration des tubérosités iliaques postérieures et si besoin antérieures. Une faible quantité de moelle est prélevée à chaque geste (3 à 5 ml). Le volume final dépend de la richesse médullaire afin d’assurer environ 3X108 cellules nucléées/kg de poids du receveur. La moelle, recueillie sur une poche contenant un anticoagulant, est ensuite filtrée et concentrée et, en cas d’incompatibilité majeure désérythrocytée, puis simplement transfusée au receveur.
Suivi
L’isolement dure environ 5 à 6 semaines, période de soins intensifs où sont traitées les complications toxiques induites par le conditionnement, et immunologiques liées à la greffe. Les produits sanguins sont irradiés pour éviter tout risque de réaction du greffon contre l’hôte. Le malade sera ensuite suivi en hôpital de jour et en consultation 6 à l2 mois, voire beaucoup p1us. Le coût moyen de l’ensemble du traitement est estimé à 800 000 F.
TRAITEMENT IMMUNOSUPPRESSEUR APRES GREFFE
Son but est de prévenir ou traiter la réaction du greffon contre l’hôte (GVH), principale complication de 1a greffe de moelle allogénique. Globalement, l’incidence de GVH aiguë de grade II-IV est de 10 à 30 p. l00 pour les greffes géno-identiques et de 70 à 90 p. l00 pour les greffes familiales non HLA identiques ou les greffes non apparentées.
PREVENTION DE LA GVH
Actuellement, le traitement de référence est l’association cic1osporine (CSA)-méthotrexate (MTX). Le MTX est injecté à la dose de l5 mg/m2 au jour l , puis de l0 mg/m2 aux jours 3, 6 et 1 l . La CSA est administrée en perfusion continue à la dose moyenne de 3 mglkglj. Lorsque le ma1ade peut s,a1imenter, vers 1a troisième semaine, 1e relais est pris per os selon la tolérance rénale et les dosages sanguins. Le traitement est poursuivi pendant au moins 6 mois puis, en l’absence de GVH, diminué très progressivement jusqu,à l’arrêt total. Les glucocorticoïdes, le SAL (sérum antilymphocytaire) et certains anticorps monoclonaux sont parfois utilisés. Le FK 506 et la rapamycine sont en cours d’étude. Enfin, les gammaglobulines polyvalentes à forte dose sont susceptibles de réduire la fréquence et la sévérité de la GVH aiguë.
TRAITEMENT DE LA GVH AIGUE
Le traitement de choix est la cortisone avec poursuite de la CSA. La corticothérapie, à la dose d’attaque de 2 à l0 mg/kg/j selon la gravité de la GVH et les protocoles locaux, est poursuivie plusieurs mois à dose lentement régressive. Le taux de réponse est de 40 à 50 p. l00 pour les GVH de grade II-IV, dont 25 p. l00 de réponse complète. La survie dépend de la bonne qualité du contrôle de la GVH. Lorsque la GVH est cortico-résistante, les traitements font appel soit au SAL, soit à différents anticorps monoclonaux (anti-T, anti-lL2R, anti-TNF, etc.) en cours d’évaluation.
TRAITEMENT DE LA GVH CHRONIQUE
Il repose sur la poursuite ou la reprise d’une pleine dose de CSA associée à une corticothérapie, le plus souvent à 2 mg/kg/j pendant l5 jours, puis très lentement diminuée. L’immunosuppression est maintenue pendant 9 mois. L’azathioprine est parfois associée à cette bithérapie, bien que son utilité n’ait pas été clairement démontrée. Certains cas de GVH chronique résistante ont été améliorés par la puvaphotothérapie, le thalidomide ou I’irradiation lymphoïde. Dans l’ensemble, l’administration correcte de l’immunosuppression a transformé le pronostic des GVH chroniques.
COMPLICATIONS IMMEDIATES ET À LONG TERME
Réaction du greffon contre l’hôte
Définition, physiopathologie
Complication principale et limitante de la greffe de moelle allogénique, la GVH a été décrite chez l’animal dans les années 50 sous le nom de maladie secondaire observée chez les souris irradiées qui recevaient des cellules spléniques allogéniques. Plus tard, chez l’homme, les premières greffes allogéniques furent grevées de complications similaires. Bien que de mécanisme encore incomplètement compris, la GVH est liée à l’activation des lymphocytes T matures du greffon qui reconnaissent sur les tissus de l’hôte une différence des antigènes majeurs ou mineurs d’histocompatibilité. L’activité cytotoxique qui en résulte est alors directe (lymphocytes cytotoxiques) ou indirecte par recrutement d’autres cellules effectrices et sécrétion de cytokines (TNF, ILl et INF). La flore digestive du receveur semble jouer un rôle dans la gravité de la GVH: les animaux élevés germ free ou soumis à une décontamination digestive totale ont une incidence de GVH et une mortalité diminuées avec certains résultats analogues à ceux observés en clinique humaine. Cela laisse supposer que certains agents microbiens ont une antigénicité croisée avec des allo-antigènes de l’hôte, ou causent une activation non spécifique des macrophages ou des cellules présentant l’antigène.
La GVH aiguë survient généralement entre 2 et 5 semaines après la greffe, avec une fréquence de 10 à 80p.l00 selon la greffe considérée. Les trois organes cibles sont la peau, le foie et le tube digestif. L’atteinte cutanée la plus évocatrice est une éruption maculopapuleuse extensive débutant souvent au niveau des paumes des mains, des plantes des pieds et des régions rétro-auriculaires. Une conjonctivite est parfois associée. Tous les intermédiaires sont possibles entre l’érythème localisé atypique et le syndrome de Lyell. L’atteinte du tube digestif, comme celle du foie, est souvent retardée et s’exprime par une diarrhée à quantifier, typiquement accompagnée de douleurs abdominales et parfois de nausées ou de vomissements. L’atteinte hépatique se traduit par un ictère avec cholestase prédominante. L’atteinte de l’état général est variable, parfois sévère avec une fièvre élevée fréquente. La GVH aiguë et son traitement retardent la reconstitution immunitaire et augmentent le risque d’infections opportunistes. Le diagnostic clinique doit le plus souvent être confirmé par l’examen histologique montrant une destruction sélective des cellules épithéliales : cellules basales de l’épiderme, canalicules biliaires et cellules des cryptes intestinales. Une classification clinique en 4 grades, selon le degré d’atteinte de chaque organe cible, permet d’apprécier la sévérité de la GVH : grades I et II ont un pronostic favorable, alors que la mortalité des GVH de grade IV avoisine 100p.l00.
Par définition, la GVH est dite chronique lorsqu,elle survient l00 jours ou plus après la greffe, mais ses manifestations peuvent être plus précoces ou très différées. La GVH chronique est le plus souvent précédée d’une phase de GVH aiguë mais peut aussi survenir de novo. Elle se voit chez environ 50p.l00 des patients et est responsable de la mort de 5p.100 d’entre eux. Elle est c1assée habituellement en forme limitée (à la peau et/ou anomalies fonctionnelles du foie) ou extensive. L’atteinte de l’état général aggrave le pronostic. La symptomatologie de la GVH chronique évoque certaines maladies systémiques comme la sclérodermie, le syndrome de Sjögren ou la cirrhose biliaire primitive. Les atteintes de la peau, des muqueuses (bouche, et vagin) et du foie sont les plus fréquentes. Histologiquement existent une nécrose épithéliale, un infiltrat mononucléaire riche en cellules CD8+ et une fibrose épithéliale et sous-épithéliale. La GVH chronique entraîne la persistance d’un déficit immunitaire combiné sévère responsable d’infections tardives potentiellement mortelles.
Facteurs de risque Les principaux facteurs de risque de la GVH aiguë sont la non-identité HLA, que le donneur soit apparenté ou non, certaines caractéristiques du donneur (allo-imunisation, sexe féminin quel que soit celui du receveur, âge) et du receveur (âge). Le principal facteur de risque pour la GVH chronique est la préexistence d’une GVH aiguë.
Effet GVL (greffon versus leucémie) La GVH aiguë ou chronique diminue le risque de rechute, après greffe, des leucémies aiguës et myéloïdes chroniques. La survie n’est significativement augmentée que si la GVH aiguë ou chronique est modérée. Ce fait est à rapprocher du risque accru de rechute leucémique après greffe syngénique ou déplétée en lymphocytes T et de l’efficacité des transfusions des leucocytes du donneur dans le traitement des rechutes après greffe des leucémies myéloïdes chroniques.
Choix du donneur La prophylaxie de la GVH repose sur le choix du donneur et sur l’immunosuppression. Le typage HLA se fait classiquement par méthode sérologique couplée à la culture mixte lymphocytaire, mais tend à être remplacé par le typage par biologie moléculaire. Le donneur de moelle peut être un jumeau monozygote (greffe syngénique); il n’y aura alors ni GVH ni GVL. Le plus souvent, il est un membre HLA-identique de la fratrie. En 1’absence de donneur géno-identique, est recherché soit un donneur fami1ial partiel1ement identique soit, plus volontiers, un donneur non apparenté phéno-identique pour le système HLA. Un donneur géno-identique est retrouvé dans 30 p. 100 des cas, un donneur non apparenté dans 30 p. 100 supplémentaires grâce à la coopération des registres internationaux et de France Greffe de moelle.
Rejet
L’absence de prise de greffe est devenue exceptionnelle au cours des greffes familiales, sauf si le greffon a été déplété en lymphocytes T. Dans les greffes avec donneur non apparenté, cette complication, le p1us souvent mortelle, survient dans 5 à l0 p. l00 des cas. Dans certains cas, se produit une reconstitution hématologique autologue que seule l’étude du chimérisme peut objectiver. Le rejet est à différencier des insuffisances médullaires secondaires parfois profondes et durables, dont les causes sont multiples.
Maladie veino-occlusive du foie
Définition, physiopathologie Cette atteinte toxique du foie est définie histologiquement par une obstruction non thrombotique de la veinule centrolobulaire avec atteinte des hépatocytes et des sinusoides avoisinants. Un faisceau d’arguments plaide pour une lésion primitive, induite par la chimioradiothérapie du conditionnement, de l’endothélium des capillaires sinusoïdes et de la veinule centrolobulaire.
Aspects cliniques La MVO (maladie veino-occlusive du foie) est une complication majeure qui survient dans les quatre premières semaines et dont l’incidence varie de 3 à 50p.l00 selon les modalités du diagnostic et les greffes considérées. La mortalité est de 30p.l00 (0-90p.l00), plus par défaillance multiviscérale, notamment rénale et pulmonaire, que par insuffisance hépatocellulaire. Le diagnostic clinique repose sur l’existence, à l’exclusion d’une autre hépatopathie connue, de 2 des 3 critères suivants : ictère, hépatomégalie ou douleur de l’hypocondre droit, ascite ou prise de poids inexpliquée. Une thrombopénie précoce et réfractaire aux transfusions attire l’attention. Une biopsie hépatique transveineuse affirme le diagnostic dans certains cas. Les facteurs de risque les plus importants sont l’élévation des SGOT avant la greffe, la dose de l’irradiation et le débit de dose, la dose de busulfan.
Traitement Les mesures prophylactiques sont controversées : l’héparine (l00 UI/kg/j), l’acide urso-désoxycholique et la prostaglandine El vasodilatatrice, cytoprotectrice et inhibant l’agrégation plaquettaire semblent intéressants. Le traitement curateur comporte des mesures non spécifiques pour maintenir une pression veineuse centrale et une perfusion rénale suffisantes sans augmenter l’extravasation; toute autre toxicité hépatique médicamenteuse doit être évitée.
Complications infectieuses
Première période Pendant la phase de neutropénie induite par le conditionnement, soit 2 à 3 semaines avant la prise de greffe, les facteurs de risque sont la neutropénie, la mucite et le cathéter veineux central. C’est la période des infections bactériennes, fungiques et éventuellement à virus Herpès simplex. Grâce à l’isolement en flux laminaire, aux mesures d’aseptie, à la décontamination digestive et aux antibiotiques à très large spectre prescrits dès la survenue d’un épisode fébrile, le problème des infections bactériennes a presque complètement disparu, avec une réserve pour les infections à staphylocoques à coagulase négative et à streptocoques. Les réactivations fréquentes des infections à virus Herpès simplex de type l, aggravant la mucite, sont prévenues par de petites doses d’aciclovir. Les septicémies à levures, en particulier à Candida, restent une préoccupation. Leur fréquence est de moins de 5 p. l00, mais la mortalité est de 40 à 80 p. l00. Le pronostic dépend de la rapidité d’institution de l’amphotéricine B en IV et surtout du nombre des polynucléaires neutrophiles. Dans cette situation, l’apport des facteurs de croissance hématopoïétique (G-CSF, GM-CSF et peut-être M- CSF) est potentiellement bénéfique.
Le mode de prévention est controversé. Le fluconazole (400 mg/j) semble efficace pour prévenir des septicémies à Candida albicans, mais il pourrait favoriser l’émergence de levures naturellement résistantes.
Deuxième période Jusqu’au 100è jour après la greffe, les facteurs de risque sont alors l’existence d’une GVH aiguë et l’intensification du traitement immunosuppresseur qu’elle impose. C’est la période de survenue des infections à CMV, à Aspergillus et à parasites. La fréquence de l’infection à CMV est de 50p.l00 et le pic de survenue, les 7e et 8e semaines. Le facteur de risque majeur est la séropositivité du receveur, car il s’agit le plus souvent d’une réactivation virale. Parmi les manifestations cliniques de la maladie à CMV, la pneumopathie interstitielle est la plus redoutable. Sa fréquence et sa mortalité ont diminué grâce à un meilleur contrôle de la GVH, une prophylaxie plus efficace, un diagnostic plus précoce et un traitement plus actif. La prophylaxie repose sur la transfusion de produits sanguins séronégatifs lorsque le receveur est lui- même séronégatif. Lorsque le receveur est séropositif, la prophylaxie peut faire appel aux gammaglobulines à fortes doses, à l’aciclovir à fortes doses ou au DHPG (di-hydroxy-profoxyméthyl-guanine). Le traitement de la maladie avérée associe DHPG et gammaglobulines. Les facteurs de croissance hématopoïétique permettent de limiter la toxicité hématologique du DHPG.
L’ aspergillose invasive représente actuellement la première cause de mortalité infectieuse après greffe de moelle allogénique. Sa fréquence varie de l à l0p.l00 et sa mortalité de 80 à l00p.l00. Le pic de survenue se situe au 3e mois après la greffe. Les facteurs de risque les plus importants sont la neutropénie profonde et prolongée, la corticothérapie et la charge de l’air en spores aspergillaires. L’isolement en flux laminaire assure une protection quasi totale pendant la période de neutropénie; le problème reste entier lorsque le malade sort du service car, à ce jour, aucune prophylaxie n’a fait sa preuve et aucun traitement n’est suffisamment efficace.
Les infections parasitaires à P. carinii et à T. gondii ont pratiquement disparu grâce aux prophylaxies médicamenteuses, qu’il faut poursuivre pendant toute la durée de l’immunosuppression.
Troisième période Caractérisée par un déficit immunitaire humoral et cellulaire persistant ainsi que par des anomalies de fonctionnement du système réticulo-endothélial, cette période est d’autant plus prolongée qu’il existe une GVH chronique. C’est la période de risque pour les infections à VZV (virus herpès-varicelle- zona) et à bactéries encapsulées. Les infections à VZV correspondent le plus souvent à une réactivation virale et se traduisent habituellement par un zona. Le pronostic a été transformé par l’aciclovir à fortes doses en IV. Les infectians à bactéries encapsulées (5. pneumoni, N. meningitidis, H. influenzae) représentent un danger potentiellement mortel à cause d’une évolution parfois fulgurante. La prophylaxie, par une pénicilline le plus souvent, doit être poursuivie plusieurs années. L’apport des vaccins est incertain chez ces patients. Lorsque le taux des gammaglobulines est bas, il est souhaitable de le supplémenter.
Complications à long terme et qualité de vie
Indépendamment de la GVH chronique et des infections tardives souvent intriquées, il faut citer les complications dues au conditionnement et/ou aux traitements immunosuppresseurs postgreffe, notamment à la corticothérapie : cataracte, troubles de croissance, insuffisances hormonales diverses avec stérilité fréquente, nécroses osseuses aseptiques et deuxième cancer dont le risque, comparé à celui de la population générale, apparaît augmenté. Une enquête auprès de 90 patients greffés entre l984 et l989 à l’hopital Saint-Louis a montré que 65 p. l00 d’entre eux pensaient avoir repris une vie normale, en moyenne l9 mois après la greffe.
RESULTATS SELON L’INDICATION
Toutes indications confondues, la survie à l0 ans des 800 patients greffés à l’hopital Saint-Louis depuis l973 est de 40 p. l00. À titre indicatif, un rapport d’activité de la SFGM en l992 montre une survie à 28 p. l00 pour les 257 patients greffés à partir d’un donneur non apparenté depuis l986.
LEUCEMIES AIGUES MYELOBLASTIQUES (LAM)
Le pronostic des LAM traitées par chimiothérapie est mauvais, à l’exclusion des leucémies promyélocytaires, avec un taux de guérison d’environ 25p.l00. Aussi la greffe est-elle proposée en première RC (rémission complète) chez l’adulte comme chez l’enfant, lorsque existe un donneur géno-identique. Pour une phase plus avancée de la leucémie, la greffe pourra être faite en situation géno-identique ou non car il n’y a plus aucune possibilité de guérison avec la chimiothérapie. En première RC, la survie est de 50p.l00 (85p.l00 chez l’enfant), le taux de rechute de 20 p. l00. En deuxième RC, la survie est de 30 à 40 p. l00 avec un taux de rechute d’environ 50 p. l00. Au-delà, et pour les leucémies réfractaires d’emblée, les possibilités de guérison ne dépassent guère l0 p. l00, aussi bien à cause des rechutes que d’une augmentation de la toxicité de la greffe.
LEUCEMIES AIGUES LYMPHOBLASTIQUES (LAL)
La greffe est proposée en première RC lorsque le pronostic est défavorable, c’est- à-dire, chez l’adulte, quelles que soient les caractéristiques de la maladie, et chez l’enfant pour les formes hyperleucocytaires ou à localisations extramédullaires, de phénotype non T ou comportant une anomalie cytogénétique comme la translocation t(4; ll), t(9; 22) ou t(8; l4) ou encore lentement sensibles à la chimiothérapie d’induction. En première RC, le taux de survie est de 60p.l00 et le taux de rechute de 30p.l00. Au-delà, le taux de survie est de 30 p. l00 et le taux de rechute de 40 p. l00 au moins. Un donneur non apparenté ne sera recherché que pour les greffes faites au-delà de la première RC, sauf s’il existe une translocation de mauvais pronostic.
LEUCEMIES MYELOIDES CHRONIQUES (LMC)
La LMC est constamment mortelle en une médiane de 4 ans. La greffe de moelle allogénique, lorsqu’elle est possible, en a transformé le pronostic car la survie sans rechute, soit la guérison, est actuellement de 55 à 60p.l00. Le taux de rechute est d’environ 25p.l00. Les résultats sont encore meilleurs si le malade a moins de 40 ans et surtout s’il est greffé dans les deux premières années suivant le diagnostic. Ici encore, du fait de l’augmentation du taux des rechutes et des toxicités inhérentes à la greffe, la qualité des résultats diminue avec l’avancement du stade de la maladie : 30 à 40 p. l00 de guérison si la greffe est faite en deuxième phase chronique ou en accélération, moins de 20 p. l00 en transformation aiguë. La gravité de la LMC justifie que la greffe soit faite à partir d’un donneur non apparenté si la maladie est résistante au traitement par l’interféron ou s’il existe des signes d’accélération. En cas de rechute après greffe, l’interféron et/ou les transfusions de leucocytes du donneur (DLI) peuvent induire une deuxième RC, illustration clinique de l’effet GVL.
AUTRES HEMOPATHIES MALIGNES
Depuis quelques années, la greffe de moelle allogénique est devenue le traitement de choix des myélodysplasies primitives et secondaires dont le pronostic était auparavant réservé. Les greffes dans les lymphomes non hodgkiniens, la maladie de Hodgkin, le myélome et la leucémie lymphoïde chronique sont en cours d’évaluation clinique.
APLASIES MEDULLAIRES
La greffe de moelle allogénique est le seul traitement curateur de l’aplasie médullaire grave définie par la présence de deux des critères suivants : réticulocytes inférieurs à 20 x l09/l, polynucléaires inférieurs à 0,5 x l0E9/l, plaquettes inférieures à 20 x l09/l. Parfois, l’indication est portée dans une aplasie moins sévère après échec du traitement immunosuppresseur ou encore en cas de thrombopénie réfractaire menaçante. Le choix du meilleur conditionnement est controversé : le cyclophosphamide seul, classique, est associé à un risque important de rejet primaire ou secondaire, surtout si le patient est âgé et a été multitransfusé. L’intensification du conditionnement par adjonction d’une TBI ou d’une irradiation thoraco-abdominale diminue le risque de rejet, mais augmente significativement le risque de cancer secondaire. L’association cyclophosphamide et SAL (sérum antilymphocytaire) est peut-être intéressante. Depuis une dizaine d’années, les chances de guérison sont de 65 à 80 p. l00 selon l’âge du patient et le nombre des transfusions antérieures. Ces progrès sont multifactoriels : conditionnement plus intensif, meilleure politique transfusionnelle (produits déleucocytés ou irradiés), meilleure prophylaxie de la GVH (MTX et CSA), raccourcissement du délai diagnostic-greffe. En revanche, dans cette indication,les résultats des greffes non apparentées sont encore très insuffisants du fait du rejet ou de la GVH. Cette indication ne doit donc être discutée que dans les cas très sévères et après échec de toutes les autres thérapeutiques.
L’aplasie de Fanconi, maladie congénitale autosomique recessive, d’évolution constamment fatale, se situe à part. Les cellules de l’organisme sont caractérisées par une fragilité anormale aux agents alkylants. La réduction nette de l’intensité du conditionnement ainsi qu’une prévention de la GVH par CSA seule, nous a permis d’atteindre une survie actuarielle de 80 p. l00.
AUTRES INDICATIONS
Il existe une trentaine de maladies héréditaires potentiellement curables par la greffe de moelle allogénique. Parmi elles, citons les déficits immunitaires mixtes et graves, les thalassémies majeures et les drépanocytoses.
CONCLUSION
La greffe de moelle allogénique est une technique hautement spécialisée qui nécessite d’importants moyens en personnel et en équipement. Elle représente le meilleur traitement, malgré son coût d’un certain nombre d’affections hématologiques, malignes ou non . Néanmoins, d’ importants progrès restent à faire dans de nombreux domaines. Nous en citerons trois : les conditionnements à la greffe doivent gagner en activité antitumorale et perdre en toxicité; des techniques de prévention plus efficaces de la GVH sont nécessaires et, dans cette optique, la dissociation des effecteurs de la GVH de ceux de l’effet GVL pourrait être d’un grand apport; le pool des donneurs non apparentés doit être augmenté, les typages doivent être plus précis et les recherches aboutir plus rapidement. Enfin, une nouvelle source de cellules hématopoïétiques peut être utilisée chez l’homme : le sang du cordon ombilical. Cette technique apparaît déjà prometteuse pour les greffes intrafamiliales. Certains arguments expérimentaux laissent espérer que cette méthode pourrait être intéressante dans les greffes non apparentées.
Prélèvement et Conservation d’Organes
-* Auteurs : D. HOUSSIN ET F. FILIPPONI
- Ouvrage: Traité de Médecine (3ème édition), éd. Flammarion
- Date de publication: septembre 1996
Nous sommes conscients que cet article est relativement ancien; toutefois, il renferme des renseignements qui vous seront sans doute utiles; aussi l’avons-nous laissé en ligne. Par ailleurs, si vous disposiez d’articles plus récents sur le même sujet, n’hésitez pas à nous en faire part afin de demander leur autorisation à leurs auteurs pour une publication en ligne sur ce site
Les années 80 ont été marquées par un formidable essor des greffes d’organes, en particulier du foie, du coeur et des poumons. Le prélèvement d’organes, limité jusqu’alors aux reins, s’est modifié: le concept de prélèvement multiorganes s’est banalisé. Parallèlement, des progrès importants dans la conservation ont permis de prolonger les durées d’ischémie froide de certains organes (notamment le foie) sans dégrader leur valeur fonctionnelle. Mais, en dépit d’efforts constants menés par les équipes de transplantation pour développer les greffes, la pénurie d’organes reste un problème inquiétant.
CONSERVATION D’ORGANES
Le but principal de la conservation d’organes est de maintenir la viabilise des differents organes ex vivo pour une periode de temps qui peut aller jusqu’à 48 heures, suffisante pour le transport eventuel des organes du centre preleveur vers les centres transplanteurs, leur attribution selon le degre d’urgence, de priorite ou de meilleure compatibilite tissulaire, I’utilisation de tous les organes prelevables. La gestion de ces organes est tres differente selon qu’il s’agit d’un organe vital comme le coeur le foie et le poumon, ou du rein pour lequel un retard a la reprise de fonction du greffon est tolerable « race au recours a l’hemodialyse.
Principe de la conservation: la refrigeration
En normothermie (37 °C) I’interruption de la vascularisation d’un organe (ischemie) entrame la necrose cellulaire rapide. L’ische’mie chaude, lorsque l’organe n’est plus perfuse par le sang du donneur mais n’est pas encore refrigere, est une periode tres mal toleree et ne doit pas depasser quelques minutes. La protection des organes contre les lestons dues a l’ischemie chaude repose sur la refrigeration, car la diminution de la temperature des tissus entraine un effondrement de leurs besoins energetiques (les besoins en O2 à 5°C sont a 5% de leur valeur a 37°C) L’ischemie en hypothermie ou ischemie froide dure depuis le lavage refrigerant de l’organe jusqu’a sa reperfusion chez le receveur. Elle ne stoppe pas totalement le metabolisme cellulaire, mais ralentit les vitesses des reactions enzymatiques et retarde la mort cellulaire. Le support biochimique des modifications cellulaires provoquees par l’ischemie froide est le suivant: inactivation de la pompe a sodium par le froid et par le deficit en ATP avec penetration intracellulaire de sodium puis d’eau et « onflement cellulaire; modification du metabolisme du glucose qui ne peut plus suivre la voie hautement energetique de la glycolyse aerobie integree au cycle de Krebs normalement producteur d’electrons reducteurs permettant les phosphorylations oxydatives au niveau des cha’ines respiratoires mitochondriales et la regeneration d’ATP. Au cours de l’ischemie froide, le metabolisme s’oriente vers la glycolyse anaerob -ie, generatrice d’acide lactique avec acidification tissulaire, rupture des membranes Iysosomales et destruction cellulaire par les enzymes Iytiques liberees; lors de la reperfusion, I’oxygene est transforme en radicaux libres de type peroxydes et superoxydes, tres toxiques pour les membranes cellulaires.
Les techniques de refrigeration reposent sur la perfusion hypothermique des vaisseaux afferents au greffon a l’aide d’une solution a 4°C,
soit in situ, lors d’un prelevement sur donneur en etat de mort cerebrale. Les organes sont laves et refrigeres dans le corps du donneur avant leur explantation, en substituant au moment de l’arret circulatoire la perfusion du liquide refrigerant a la circulation sanguine. Cette perfusion supprime toute ischemie chaude;
soit ex vivo, lors d’un prelevement sur donneur vivant. Immediatement apres la deconnexion, I’artere du greffon (ou la veine porte dans le cas du foie) est perfusee par simple gravite en jugeant l’efficacité sur la decoloration de l’organe et la clarte du retour veineux.
Le greffon est ensuite conserve:
soit par simple immersion de l’organe dans un liquide maintenu entre 4 et 8 oc, technique la plus repandue, simple, peu couteuse et efficace quel que soit l’organe considere. Le greffon baignant dans son liquide de conservation est hermetiquement et sterilement place dans un recipient protege par un emballage en plastique sterile et enfoui dans de la glace pilee au sein d’un conteneur isotherme;
soit par perfusion continue hypothermique, technique reservee aux greffons renaux, necessitant un appareillage sophistique et dont le benefice n’apparaît qu’au-delà de la 48e heure de conservation et pour 24 heures supplementaires. Le rein est canule et perfuse en permanence selon un mode pulsatile par une solution refrigerante oxygenee, avec controle constant de la temperature, de la pression de perfusion et des caracteristiques biochimiques.
Liquides de conservation
Les consequences deleteres de l’ischemie froide peuvent etre attenuees par la composition de solutions refrigerantes de conservation. Les liquides de conservation permettent de recuire l’cedcnne cellulaire en retablissant une pression osmotique extracellulaire, de prevenir l’acidose intracellulaire, de limiter l’expansion de l’espace interstitiel lors de la perfusion de l’organe ainsi que les lestons de reperfusion dues aux radicaux libres accumules.
L’UTILISATION HABITUELLE DES SOLUTIONS DE CARDIOPLÉGIE
L’utilisation des solutions de cardioplegie, riches en potassium et hyperosmolaires, dans la chirurgie a cceur ouvert, a ete etendue a la conservation du greffon cardiaque. Leurs performances moyennes autorisent des durees de conservation de 3 a 6 heures seulement.
SOLUTION D’EURO-COLLINS
Mise au point par l’equipe de Collins pour conserver les greffons renaux, cette solution a une forte osmolarite liee a des concentrations elevees en glucose et en potassium. Cette solution adoptee a l’echelon europeen facilite les echanges, en particulier de reins, entre centres de transplantation et autorise des celais de conservation de 48 heures pour le rein. Elle est beaucoup moins performante pour les greffons hepatiques et pancreatiques, qui ne peuvent etre conserves en toute securite que 6 a 8 heures. Le glucose, principal impermeant de l’Euro-Collins, est mal adapte a la conservation hepatique. En effet, il penetre dans les hepatocytes, ou sa phosphorylation en glucose-6-phosphate est inactivee par la glucokinase; cette enzyme n’étant pas inhibee par le glucose-6-phosphate, le glucose est rapidement metabolise en acide lactique. Dans le rein, au contraire, la phosphorylation du glucose est sous la dependance d’une hexokinase soumise au retrocontrole negatif du glucose-6-phosphate: I’autoregulation du metabolisme du glucose explique la meilleure tolerance de la solution d’Euro-Collins par le rein.
SOLUTION DE L’UNIVERSITE DU WISCONSIN (SOLUTION UW)
Mise au point par l’equipe de Belzer et Southard a Madison, la solution UW a permis de porter la duree de conservation hepatique de securite a 15 heures et d’augmenter les echanges de pancreas et de foie entre les differents centres. Son efficacite dans la conservation des greffons cardiaques est en cours d’evaluation.
PRELEVEMENT D’ORGANES
Jusqu’à present, I’espece humaine est le seul << reservoir >> d’organes prelevables en vue de transplantation. Ces prelevements s’effectuent chez le sujet en etat de mort cerebrale et parfois chez le donneur vivant.
1. Chez le sujet en mort cerebrale
Un coeur, deux poumons, un foie, un pancreas, deux reins, un segment intestinal et des tissus divers sont potentiellement disponibles dans le cadre d’un prelevement multiorganes.
MORT CEREBRALE
Le sujet en mort cerebrale est un cadavre dont l’activite cardiaque est temporairement conservee par un mecanisme reflexe a l’etage sous-encephalique, et dont l’activite respiratoire et la stabilise hemodynamique sont maintenues art)ficiellement de maniere transitoire. Quelle que soit l’etiologie (traumatisme cranien, hemorragie intracranienne, anoxie cerebrale), le substrat physiopathologique de la mort cerebrale est le meme: constitution d’un cedeme cerebral tel que la pression intracranienne devient superieure a la pression intraluminale des vaisseaux cerebraux. II s’ensuit une necrose ischemique irreversible du cerveau et du tronc cerebral [1, 3].
La destruction du systeme nerveux intracranien entra’ine:
la liberation des centres medullaires sousjacents permettant a un automatisme medullaire de s’exprimer, d’ou la persistance possible des reflexes osteo-tendineux et un signe de Babinski;
la suppression des stimuli centraux des centres inspiratoire et expiratoire, du centre cardio-moteur avec baisse de la competence myocardique par reduction de l’inotropisme, et de chemo- et barorecepteurs dont les arcs reflexes sont detruits, interrompant l’activite du centre vasoconstricteur et entraînant une vasoplegie;
la destruction du centre thermoregulateur hypothalamique: la perte thermique de l’ordre de I oc par heure resulte d’une diminution de la thermogenese par arret de la production de chaleur metabolique et par diminution du travail musculaire associee a un accroissement de la thermolyse peripherique liee a la vasoplegie;
des troubles metaboliques et des anomalies de la permeabilite membranaire lies au ralentissement circulatoire, a l’hypoxie tissulaire, a l’hypothermie, a l’inhibition des ATPases membranaires et a l’acidose. II en resulte des perturbations hydro-electrolytiques avec hypokaliemie, des troubles de l’equilibre acido-basique avec tendance a l’egalisation des pH intra et extracellulaire, et au niveau renal un diabete insipide par diminution de la secretion d’ADH, liee a l’alteration du diencephale et a la destruction de l’axe hypothalamo-hypophysaire. La polyurie s’accompagne d’une hyperkaliurie et d’une hypernatremie. La permeabilite membranaire accrue augmente la lactacidorachie;
des perturbations hemodynamiques avec hypovolemie secondaire a la deshydratation, a la vasoplegie et a la chute de l’ADH (antidiuretic hormone, hormone antidiuretique) et une defaillance myocardique, caracterisee par une tendance a la bradycardie qui peut favoriser une fibrillation ventriculaire et une alteration de la contractilite, une chute du debit cardiaque, une hypotension systemique, une insuffisance circulatoire generalisee debutant par les reins, le pancreas, le foie [2].
Le diagnostic de mort cerebrale est evoque cliniquement devant un coma profond areactif avec: a) abolition de toute activite dans les territoires des nerfs craniens; les reflexes corneens et photomoteurs sont abolis avec une mydriase bilaterale areactive; par contre, une activite medullaire peut persister (reflexes osteo-tendineux, reflexes cutanes plantaires, priapisme); b) abolition de la respiration spontanee, verifiee par une epreuve de debranchement du respirateur de 15 minutes.
Le diagnostic de mort cerebrale est confirme par le trace electro-encephalographique nul, soit deux traces EEG isoelectriques enregistres chacun pendant 2O minutes (avec au moins IO electrodes et trois niveaux de sensibilise) a 3 heures d’intervalle. Le silence electro-cortical depourvu de toute reactivite aux stimulations auditives ou nociceptives est un critere fiable de mort cerebrale si les conditions techniques sont rigoureusement mises en _uvre. Cet examen est un document medico-legal indispensable selon la circulaire Jeannerey d’avril 1968. D’autres examens complementaires, non indispensables au plan medico-legal, peuvent apporter une aide au diagnostic: potentiels evoques, modifications du liquide cephalo-rachidien, avec augmentation significative des ASAT (aspartate aminotransferase) et des LDH (lacticodeshydrogenase), arteriographie cerebrale qui fournit la preuve de l’arret circulatoire arteriel.
PRISE EN CHARGE MEDICALE DU DONNEUR AVANT ET PENDANT LE PRELEVEMENT
Afin de maintenir pendant 12 a 24 heures, jusqu’au prelevement, une oxygenation et un etat hemodynamique satisfaisants dans des conditions d’asepsie rigoureuse, le donneur est equipe: electrocardioscope, sonde d’intubation tracheale, sonde gastrique, sonde vesicale, sonde thermique, catheter arteriel radial, sonde de Swan-Ganz dans l’artere pulmonaire, acces veineux central, 2 voies veineuses peripheriques. La surveillance de la frequence cardiaque, la pression arterielle, la diurese horaire, la pression veineuse centrale (ou pression arterielle pulmonaire) est couplee a la surveillance biologique des urines et du sang toutes les 6 heures. L’assistance ventilatoire est obligatoire, les centres de commande du tronc cerebral etant detruits. Le malade est intube, ventile avec une FiO2 de 40 p. I OO de maniere a garder une PaO2 superieure a IOO mmHg et une PaCO2 entre 3O et 4O mmHg. La liberte de l’arbre tracheo-bronchique est assuree par des aspirations bronchiques effectuees aseptiquement.
La pression arterielle systolique est maintenue au-dessus de IOO mmHg par remplissage vasculaire (albumine, plasma frais, concentres erythrocytaires) et l’hematocrite doit rester superieur a 3O p. IOO. La pression veineuse centrale doit se maintenir entre 5 et IO cmH2O. Si, dans ces conditions, I’etat hemodynamique reste precaire, le recours aux catecholamines est indique (dopamine a doses inferieures a 6 pg/kg/min, puis dobutamine). La diurese est compensee volume a volume en alternant serum glucose a 2,5 p. IOO et serum sale a O,9p.1OO. L’apport electrolytique tend a corriger l’hypokaliémie, I’hypocalcemie et l’hypernatremie. En cas de polyurie superieure a SOO cm, la vasopressine peut etre administree.
Les infections, en particulier pulmonaires, sont prevenues par une antibioprophylaxie ciblee sur les enterobacteries et le staphylocoque dore.
VALIDATION DU DONNEUR
L’etape initiale de l’organisation d’un prelevement multiorganes permet de verifier l’absence de contre- indication au prelevement d’un ou de plusieurs organes. Les donnees suivantes sont analysees: a) age du donneur; b) cause de la mort ce’re’brale; c) recherche d’ante’cedents d’hypertension arterielle, de diabete, d’une affection hepatique chronique ou aiguE, de tout autre antecedent medico-chirurgical, les notions de toxicomanie ou d’homosexualite etant importantes a connaitre; d) examen clinique recherchant des stigmates de contusion thoracique ou abdominale avec mesure de la taille, du poids et du perimetre basithoracique du donneur; e) pre’levements biologiques sanguins et urinaires mesurant les fonctions renales, hepatiques, pancreatiques avec serologies des virus de l’hépatite B, VIH et CMV, hemocultures, prelevements tracheaux et urinaires pour examen bacteriologique; 1) ECC et radiographie du thorax, echographie cardiaque au moindre doute; g)echographie abdominale a la recherche d’un epanchement peritoneal, d’un hematome sous- capsulaire ou intraparenchymateux du foie, et precisant les dimensions de cet organe; h) groupage sanguin et typage HLA.
Au terme de ce bilan peuvent apparaître des contre-indications au prelevement d’ordre general ou specifiques d’un organe: a) criteres gene’raux d’exclusion (cancer_sauf tumeurs cerebrales primitives, infection evolutive non eradicable_dont l’infection due au virus VIH); b) criteres d’exclusion du pre’levement re’nal (age superieur a 6O ans, pathologie uro-nephrologique preexistante, fonction renale alteree maigre une reanimation correcte, hypertension arterielle severe, diabete); c) criteres d’exclusion du prelevement cardiaque (age superieur a 45 ans_en fonction de 1’urgence de la greffe_, pathologie cardiaque associee, mauvaise hemodynamique maigre une reanimation correcte; d) criteres d’exclusion du pre’levement hepatique (age superieur a SS ans_a discuter en fonction de l’urgence_, pathologie hepatique associee, anomalie majeure de la biologie hepatique).
DEMARCHES MÉDICO-LÉGALES
Les prelevements d’organes sur des patients en etat de mort cerebrale sont autorises en France par le decret no 78SOI du 31 mars 1978 pris pour 1’application de la loi du 22 decembre 1976 (loi Caillavet) et publie au Journal officiel du 4 avril 1978. La loi, appliquant la conception du consentement presume., fait de tout sujet decede un donneur d’organe potentiel, si celui-ci ne s’est pas oppose a cette procedure de son vivant. Elle fait aussi obligation aux medecins d’informer les proches du donneur de l’intention de prelever les organes, puisqu’ils sont les depositaires privilegies des volontes exprimees par le defunt, verbalement ou par ecrit. Le refus de la famille n’a pas theoriquement a etre pris en compte s’il ne s’accompagne pas de justifications affirmant la position personnelle du donneur.
Le coordinateur, selon la loi, doit informer du prelevement le directeur de l’hopital, faire signer le constat du deces par deux medecins avant l’entree en salle d’operation, prevenir le Procureur de la Republique si, a l’origine du coma depasse, il y a crime, suicide, accident du travail ou toute autre raison pouvant justifier une autopsie medico-legale et recevoir l’autorisation signee du tuteur legal dans les cas d’un mineur ou d’un incapable.
LOGISTIQUE DU PRELEVEMENT
Le coordonnateur est charge d’informer les equipes locales de prelevement et France Transplant des que le diagnostic de mort cerebrale est pose. France Transplant, association Loi 19OI fondee en 1969 par le professeur J. Dausset et reconnue d’utilite publique le 18decembre 1978, a ete recemment integree dans 1’Etablissement fran,cais public charge des greffes d’organes, mais aussi de moelle et de tissus.
L’organisation du prelevement contribue a prendre en charge le malade pour lequel l’indication de transplantation a ete posee: avant la greffe, en assurant son inscription sur la liste d’attente nationale dont elle assure l’accessibilite 24 heures sur 24 et la mise a jour; au moment du pre’levement et de la greffe, en assurant la coordination du prelevement, I’attribution des greffons, la logistique de communication, la saisie informatique des donnees; apres la greffe, en assurant la mise a jour du Registre national des transplantations. La repartition des organes est faite par des secretariats permanents de regulation avec sept sections regionales qui repartissent les organes dans le respect de regles nationales pour chaque organe selon differents parametres: groupe sanguin ABO, typage HLA, adequation de poids donneur/receveur. degre d’urgence, anciennete d’inscription sur la liste, priorite des multigreffes. Les priorites absolues sont d’abord prises en compte. En l’absence de priorite absolue, I’ordre de choix est local, puis en cas d’absence de receveur correspondant aux criteres retenus, le choix est regional et si besoin national vers une autre region ou vers l’etranger.
TECHNIQUE CHIRURGICALE DU PRELEVEMENT D’ORGANES
Face a la penurie de greffons, la regle est de prelever, chez un meme donneur, le plus grand nombre possible d’organes transplantables. La technique chirurgicale parfaitement rodee permet une intervention facile le plus souvent, parfois cependant emaillee d’incidents conduisant a la perte d’un ou de plusieurs organes. Les cifficultes sont lices a l’instabilite hemodynamique, aux anomalies de la distribution vasculaire, aux incidents lors de la perfusion et aux fautes d’asepsie.
Apres installation du donneur en decubitus dorsal, I’incision standard est une sterno-laparotomie mediane cervico-pubienne. L’equipe thoracique, apres avoir ouvert le pericarde, apprecie l’etat du c_ur Les chirurgiens visceraux verifient l’absence de tumeur, de foyer infectieux ou de malformation grave susceptible de contre-indiquer tout ou partie du prelevement; ils evaluent la qualite des organes et recherchent des anomalies vasculaires. Cette phase d’exploration engage lourdement la responsabilite du preleveur. Les organes sont ensuite disse-tues apres refrigeration des organes abdominaux et preparation des reins. Une partie du retroperitoine est exposee en decollant le colon droit et le duodeno-pancreas, en decrochant la racine du mesentere en direction de l’angle duodenojejunal tout en epargnant la veine mesenterique inferieure qui est utilisee pour la perfusion portale. Aorte et veine cave inferieure sont dissequees immediatement au-dessus des vaisseaux iliaques. Ces manreuvres preparent le temps ulterieur de canulation. La palpation des deux loges renales s’assure de l’absence d’anomalie.
La preparation du foie est recuite a l’ouverture de la vesicule biliaire et a son lavage par du serum physiologique, a la canulation de la veine mesenterique inferieure.
La preparation du pancreas est plus souvent segmentaire. Dans ce cas, la section entre ligatures des ligaments gastro-colique, gastro- splenique et spleno-colique precede la liberation de la rate. La rate est tenue comme une poignee pendant la suite de la dissection, pour ne pas traumatiser le pancreas. Le bord superieur est libere jusqu’a la jonction tronc cceliaque-artere splenique. La racine du mesocolon transverse est abaissee et le bord inferieur du pancreas est degage jusqu’a la veine mesenterique inferieure. Les autres temps seront realises apres refrigeration. Dans le cas de la preparation du pancreas total, apres liberation du pancreas gauche dans les memes conditions que lors du prelevement du pancreas segmentaire, est effectue le decollement duodéno-pancréatique jusqu’au plan aortique anterieur. Le controle des elements du pedicule portai, du pedicule mesenterique superieur sous l’isthme pancreatique, des afferences arterielles du pancreas et l’agrafage du quatrieme duodenum sont effectues sous refrigeration.
La preparation du coeur comprend l’ouverture et la suspension du pericarde, la liberation de l’aorte thoracique avant le depart du tronc brachiocephalique et la liberation des veines caves superieure et inferieure intrapericardiques.
a) Canulations et clampages Apres heparinisation du donneur, I’equipe cardiaque met en place la canule de cardioplegie dans la racine de l’aorte. Si les poumons sont preleves, une canule de pneumoplegie est installee dans l’artere pulmonaire. Dans le meme temps, I’equipe abdominale a canule l’aorte abdominale a sa terminaison, la veine porte et enfin la veine cave inferieure sousrenale pour la decharge. Apres clampage des veines caves intrapericardiques, de l’aorte thoracique et supra-creliaque, le cceur est rapidement arrete par la perfusion rapide du liquide de cardioplegie. La mise en route des perfusions aortique et porte a gros debit et l’ouverture de la decharge cave permettent le lavage du pancrcas, du foie et des reins. La ventilation assistee est acretee.
b) Explantation des organes Le coeur ou le bloc creur-poumons est preleve en premier lieu. Apres arret de la perfusion aortique, section des veines caves superieure et inferieure, la masse ventriculaire est reclinee vers le haut, pour sectionner les veines pulmonaires gauches, I’artere pulmonaire a sa bifurcation, les veines pulmonaires droites. L’oreillette gauche est ensuite separee de son accolement pericardique et la section de l’aorte au ras du clamp finit de liberer le greffon cardiaque, qui est immediatement immerge dans du liquide de cardioplegie a 4 oc, puis sterilement et hermetiquement isole.
Le prelevement hepatique vient en deuxieme lieu, apres avoir passe 2 a 3 litres de perfusion aortique et I a 2 litres de perfusion portale. La voie biliaire principale et l’artere gastro-duodenale sont sectionnees au ras du pancreas cephalique. L’ artere hepatique commune est dissequee jusqu ‘ a l’ artere splenique, qui est sectionnee au ras de son atterence creliaque. L. artere coronaire stomachique est egalement sectionnee, a moins qu’une artere hepatique gauche n’impose le prelevement de la totalise du pedicule de la petite courbure. Le tronc cceliaque est disse-tue jusqu’a son implantation aortique, apres section du ligament arque. La veine porte est prelevee en continuite avec un segment de veine mesenterique superieure, apres section de l’isthme pancreatique. Si le pancreas est aussi preleve, la veine porte est sectionnee a michemin entre le bord superieur du pancreas et sa bifurcation. Un segment aortique englobant l’ostium du tronc cceliaque ou les ostia du tronc cceliaque et de l’artere mesenterique superieure en cas d’artere hepatique droite est decoupe. La veine cave inferieure sous- hepatique est sectionnee au-dessus des veines renales. Au-dessus du foie, la veine cave interieure est prelevee avec une large collerette diaphragmatique. Le foie preleve, dispose dans une bassine contenant du liquide de conservation a 4 oc, est generalement relaye avec I litre de cette solution avant d’etre conditionne pour le transport.
Le prelevement pancreatique segmentaire est tres rapide. La section de l’isthme pancreatique clecouvre la jonction spleno-portale qui est decoupee en menageant un patch periostial. La preparation ulterieure comprendra la splenectomie et la fermeture de la tranche de section apres injection immediate ou ditferee de neoprene. La prevention des thromboses veineuses est assuree par la confection d’une fistule arterio- veineuse distale. Si le pancreas total est preleve, il faut, au lieu de sectionner l’isthme, agrafer le quatrieme duodenum et sectionner ensuite les vaisseaux mesenteriques supeneurs sous l’isthme du pancreas.
Le prelevement renal est simplifie par l’extraction prealable du foie et du pancreas. Le prelevement monobloc est le plus souvent pratique. La loge renale gauche est ouverte par decollement du colon gauche et incision du mesocolon gauche. Les deux ureteres sont sectionnes au niveau pelvien. L’aorte et la veine cave inferieure sont sectionnees entre les sites de canulation et les ligatures sousjacentes. Les deux reins et les deux ureteres sont souleves et le clivage se fait de bas en haut, pour ne pas leser les arteres renales parfois adherentes au plan posterieur. Le monobloc est examine sur table et les deux reins sont separes par section longitudinale des gros vaisseaux. 11 est possible de prelever et conditionner chaque rein separement apres reperage des ostia des arteres renales par voie endo-aortique et decoupe des collerettes correspondantes.
Les etapes finales permettent de prelever des ganglions mesenteriques et la rate (reservoirs de Iymphocytes pour les epreuves de compatibilite immunologique). Les deux arteres iliaques ainsi que les veines sont extraites. Les segments arteriels permettent la reunification du systeme arteriel hepatique ou pancreatique, ou autorisent une implantation aortique de l’artere hepatique du greffon lorsque celle du receveur est de mauvaise qualite. Les veines iliaques permettent un branchement de la veine porte du greffon sur la veine mesenterique supeneure du receveur en cas de thrombose de la veine porte ou un allongement de la veine porte parfois indispensable en cas de prelevement du pancreas. La fermeture parietale est particulierement soigneuse.
2. Chez le donneur vivant
Les prelevements d’organes sur donneurs vivants non apparentes ne sont pas autorises en France. Seuls sont pris en consideration les donneurs apparentes, volontaires au sein de la proche famille du receveur. La loi Cavaillet no 76-1181 du 22 decembre 1976 precise les conditions juridiques du prelevement d’organes sur un donneur vivant apparente majeur ou mineur. Un individu majeur et sain d’esprit est libre de faire don de ses organes. 11 doit etre totalement informe par le medecin des risques qu’il encourt. Le consentement libre et eclaire du donneur doit etre recueilli devant le president du TribunaL de grande instance.
Quel que soit l’organe, I’intervention chez le donneur est precedee d’un bilan visant a s’assurer de l’absence d’incompatibilite ABO avec le receveur, de l’integrite anatomique et de la valeur fonctionnelle de l’organe qui sera preleve et de l’organe restant, de la realite du consentement et de l’etat psychique du donneur, de l’absence chez lui de maladie transmissible ou de facteur de risque operatoire. Les principales etapes du bilan sont: I’entretien entre medecin, donneur(s) potentiel(s) et receveur (si adulte); I’intenrogatoire et l’examen clinique; le groupe ABO, le typage HLA et le crossmatch; I’etude de la fonction renale ou hepatique; les serologies VIH, HBV, CMV, candidose, toxoplasmose, aspergillose; la radiographie de thorax; I’ECG; I’arteriographie renale ou crelio-mesenterique.
Dans le cas du rein, la bonne compatibilite tissulaire entre donneur et receveur, la qualite du greffon et la penurie actuelle en greffons peuvent justifier le prelevement d’organes chez un donneur vivant apparente. Plus recemment, le prelevement du lobe hepatique gauche a ete pratique pour greffe chez l’enfant. Le prelevement du pancreas caudal n’est de pratique courante que dans l’equipe de Minneapolis.
PRELEVEMENT DU REIN
En France en 1990, 2,5 p. IOO des greffes renales ont ete realisees a partir de donneurs vivants. La technique est sensiblement identique a celle d’une nephrectomie classique. Le greffon est confie a l’equipe de transplantation pendant que s’acheve la fermeture de la plaie operatoire du donneur. Le prelevement renal peut etre egalement pratique par voie anterieure transperitoneale, interessante du côté droit du fait de la brievete de la veine renale. Les suites operatoires du donneur sont regulierement simples, autorisant la sortie au 7e jour.
PRELEVEMENT DU LOBE GAUCHE HEPATIQUE
Avec l’amelioration spectaculaire de ses resultats, la transplantation hepatique est devenue une methode therapeutique proposee a un nombre croissant de patients presentant une hepatopathie irreversible. Dans le but de recuire encore le risque de deces des enfants en attente de transplantation, le prelevement du greffon hepatique chez le pere ou la mere, technique complementaire de l’utilisation de greffons de cadavre entiers ou partiels, s’est impose.
PERSPECTIVES
Victime de son succes, la transplantation d’organes est en crise: I’inadequation entre le nombre des patients en attente et le nombre des organes preleves chez des patients en etat de mort cerebrale est manifeste. Faute de solutions alternatives, la proportion des patients qui vont mourir dans l’attente d’un organe salvateur ne cesse de s’accroitre. C’est ce contexte de penurie, associe au developpement fulgurant des nouvelles biotechnologies qui donne un second souffle a la recherche dans le domaine de la xenotransplantation, dont l’obstacle majeur reste encore le rejet. Lorsqu’une ressemblance genetique existe entre donneur et receveur (especes concordantes), les caracteristiques du rejet sont semblables a celles du rejet aigu d’allogrette, la reponse immune etant principalement de type cellulaire avec une reaction humorale moderee. Au contraire, les greffes entre especes eloignees (discordantes) sont a l’origine d’une reaction violente de type humoral aboutissant a la destruction rapide du greffon, du fait d’une Iyse des cellules endotheliales avec agregation plaquettaire et activation du systeme du complement et du systeme de la coagulation. Ces phenomenes presentent une forte similitude avec les rejets suraigus observes en transplantation clinique.
BIBLIOGRAPHIE
- 1. PALLIS C From braie death to braie stem death. Br Med 1, 1982, 285: 1487-1490.
- 2 RoMANo P La mort cerebrale: definition et physiopathologie. In P Lang, D Houssin Le prelevement d’organes, Paris, Masson, 1992: 33-42.
- 3. ROUGEMONT J, BARGE M, FRANKE J. Cerebral blood flow during increased subarachnoid pressure. Acta Neurochir, 1971, 25: 19-36.