- Auteur : B. CHARPENTIER
- Ouvrage: Traité de Médecine (3ème édition), éd. Flammarion
- Date de publication: septembre 1996
Nous sommes conscients que cet article est relativement ancien; toutefois, il renferme des renseignements qui vous seront sans doute utiles; aussi l’avons-nous laissé en ligne. Par ailleurs, si vous disposiez d’articles plus récents sur le même sujet, n’hésitez pas à nous en faire part afin de demander leur autorisation à leurs auteurs pour une publication en ligne sur ce site
Depuis les premieres descriptions cliniques du rejet aigu d’allogreffe, il y a une trentaine d’annees, ce probleme qui semblait irreversible et incontournable a beaucoup evolue. A l’heure actuelle, le rejet aigu d’allogreffe precoce est le plus souvent controle en augmentant l’immunosuppression; souvent ecrete, il passe inaper,cu et est difficile a distinguer des autres causes de dysfonction d’organe. Pourtant, toute transplantation implique une reconnaissance allogenique chez le receveur, donc un mecanisme immunologique beaucoup plus complexe qu’une simple reponse a un antigene soluble. D’un point de vue d’immunologie fondamentale, la transplantation d’organe ne devrait pas reussir, tant sont << fortes >> les barrieres d’histocompatibilite et tant est grande la frequence des Iymphocytes precurseurs alloreactifs. Et pourtant, la transplantation d’organes est une therapeutique efficace, avec des survies d’allogreffe de 😯 a 90p.1OO a un an.
Il y a une vingtaine d’annees, Medawar demontrait que, chez le lapin, une greffe de peau provenant d’un autre lapin etait rejetee par un mecanisme actif avec une memoire et un rejet accelere et specifique des allogreffes secondaires. Plus tard, Medawar, Brent et Billingham montraient que des animaux rendus tolerants, a leur naissance, par l’injection de cellules allogeniques, ne rejetaient pas les greffes de peau du meme donneur. Ce double concept de rejet et de tolerance continue, en grande partie, a gouverner l’immunologie de transplantation, mais la complexite de ces deux phenomenes reste telle que leur elucidation complete est encore lointaine [1, 5].
ASPECTS MORPHOLOGIQUES ET FONCTIONNELS
DU REJET D’ALLOGREFFE
Greffes de peau
Une autogreffe ou une greffe syngenique de peau est rapidement vascularisee des les 2-3 premiers jours et a un aspect normal aux 4e-5e jours; I’architecture de la peau est conservee avec seuls quelques infiltrats de cellules inflammatoires dues au traumatisme chirurgical.
Une allogreffe primaire entre deux individus genetiquement differents d’une meme espece a un comportement initial analogue a l’autogreffe avec retablissement vasculaire, mais tres rapidement s’installe une infiltration perivasculaire de Iymphocytes, Iymphoblastes, plasmocytes et macrophages. Vers le 7e jour, la greffe commence a se necroser, a s’epaissir avec necrose totale et ob*struction de la vascularisation vers le 10ème jour. Le greffon est elimine, faisant place a une cicatrice. Une difference d’histocompatibilite entre donneur et receveur accelere ce processus si elle est tres forte, le retarde parfois sur plusieurs semaines si elle est faible, donnant alors l’aspect trompeur d’une greffe toleree tandis qu’un rejet chronique peut etre demontre sur une biopsie.
Les allogreffes secondaires effectuees a distance (semaines ou mois) d’une premiere greffe sont rejetees de fa,con acceleree. L’evolution dans les 3 ou 4 premiers jours est identique a celle de la greffe primaire, hormis le cas precis du rejet hyperaigu du a des anticorps preformes. Mais des que la vascularisation de la greffe s’etablit, le rejet intense detruit le greffon entre le 5e et le 7e jour. Fait essentiel, le rejet secondaire est specifique des antigenes d’histocompatibilité du premier donneur; une deuxieme greffe d’un donneur non lie genetiquement au premier ne subit pas de rejet accelere.
Greffes d’organes
Le destin des greffes d’organes allogeniques est fondamentalement le meme que celui des greffes de peau, mais les modalites du rejet different d’un organe a l’autre, la peau etant le tissu le plus rapidement rejete [2].
Le rejet aigu d’allogreffe renale [8] debute entre le 4e et le 6e jour posttransplantation, avec infiltration de l’interstitium renal par des cellules mononucleees (Iymphocytes, monocytes, macrophages) et _dème parfois tres important. Arterioles et glomerules sont initialement normaux mais, si le rejet continue a evoluer, des lestons arteriolaires (agregats de plaquettes, de fibrine et prol i ferati on intimale) et glomerulaire s (i schemie glomerulaire , fibrose) apparaissent. Dans les rejets chroniques, I’infiltrat cellulaire inflammatoire est generalement modere; par contre la fibrose interstitielle est extensive, avec proliferation de l’intima et de la media des vaisseaux de moyen et petit calibres et lestons des glomerules aboutissant a leur destruction.
En clinique, le rejet des greffes d’organe se traduit par la perte progressive des fonctions des greffons: montee de la creatininemie et chute de la natriurese pour le rein; alteration de la fonction myocardique pour le cceur; elevation de la bilirubine, des transaminases pour le foie; hyperglycemie pour le pancreas; anomalies radiologiques et fonctionnelles respiratoires pour les poumons.
Les rejets secondaires d’organes se traduisent par un rejet accelere ou meme hyperaigu de type humoral. Ce dernier entrame une necrose typique du greffon dans les minutes ou les heures suivant la transplantation.
Cas particuliers
Sites privilegies Certaines allogreffes ne subissent pas de rejet lorsque le greffon est implante dans un site peu accessible aux Iymphocytes du systeme immunitaire (chambre anterieure de l’ceil. tissu cerebral, poche jugale du hamster).
Tissus privilegies Certains tissus peu ou pas vascularises, tel le cartilage, resistent au phenomene du rejet.
Xenogreffes Leur destin depend de l’etendue des differences entre donneur et receveur, avec des especes concordantes et discordantes. La plupart sont rapidement rejetees, parfois de fac,on hyperaigue, si le receveur possede des anticorps naturels anti-espèce du donneur.
La reaction du GVH (graft versus host ou greffon contre l’hote) peut etre consideree comme l’inverse ou le symetrique de la reaction de rejet. Le greffon developpe une reaction de rejet contre l’hote, lui-meme incapable de rejeter le greffon. Pour que cette reaction se developpe, essentiellement au cours de la greffe de moelle, il faut que les cellules greffees soient immunocompetentes (en general des Iymphocytes T) et que l’hote soit immunoincompetent pour des raisons immunologiques (irradiation, drogues immunosuppressives) ou genetiques (injection de cellules parentales a un hybride Fl).
ASPECT IMMUNOLOGIQUE DU REJET D’ALLOGREFFE
Au cours du rejet de greffe, des modifications interviennent au niveau local, c’est-a-dire le greffon, mais aussi regional (ganglions drainant le territoire de la greffe) et enfin systemique.
Au niveau du greffon
Il existe une reaction de type inflammatoire avec nombreux infiltrats perivasculaires de Iymphocytes T actives, monocytes et Iymphocytes B. Ces cellules sont capables de proliferer en presence des cellules du donneur in vitro et de les Iyser par une reaction de cytotoxicite a mediation Iymphocytaire. Un double flux cellulaire existe en sens inverse entre greffe et hote. La greffe est rapidement envahie par des cellules immunocompetentes de << phenotype receveur >> dans les aires perivasculaires, en particulier au niveau des capillaires veineux, phenomene connu depuis de nombreuses annees. Ce processus necessite la presence sur l’endothelium vasculaire et sur les cellules immunitaires de molecules complementaires d’adhesion, dont le role est fondamental pour la margination et la diapedese. L’efflux de cellules dendritiques de << phenotype donneur >>, emigrant de la greffe pour se localiser dans la rate du receveur ou elles vont etre identifiables 6 jours avant de devenir indetectables, a ete demontre recemment. Ce processus de double trafic peut etre rapproche d’un microchimerisme temporaire [4]. Un cedeme du tissu interstitiel est generalement associe, du a la production de substances solubles inflammatoires de type cytokines-lymphokines qui joueront un r61e dans l’attraction de cellules phagocytaires. Les principales cytokines, synthetis es a la phase precoce par les monocytes-macrophages, suite a la presentation de l’antigene sont l’lLI et l’lL6, fondamentales pour 1’immunocompetence des Iymphocytes T. En retour, afin d’amplifier nettement cette reponse, sont synthetises l’interferon gamma par les Iymphocytes T et le TNF (tumor necrosis factor) par les monocytes et les Iymphocytes T.
Au niveau des organes lymphoïdes
Les ganglions regionaux d’une greffe augmentent rapidement de volume, avec hypertrophie des zones paracorticales, presence de Iymphoblastes tres jeunes des les 2e-3e jours et augmentation du debit des Iymphatiques afferents et efferents. Des cellules transformees (Iymphoblastes) peuvent etre presentes dans le sang peripherique.
Cellules effectrices
Cellules T CD3 De nombreuses cellules sont impliquees dans le rejet d’allogreffe, mais les Iymphocytes T CD3+ ont un r61e predominant [3, 6, 7], et parmi eux :
les Iymphocytes T cytotoxiques (Tc , CD 8+) reconnais sent les antigenes d’histocompatibilité de classe I et possedent une cytotoxicite directe sur la cellule cible. Une cellule effectrice peut detruire successivement plusieurs cellules cibles portant le meme antigene. La molecule CD8 se lie plus specifiquement au domaine alpha 3 des molecules de classe I;
les Iymphocytes T auxiliaires (Th, CD4+) reconnaissent les antigenes de classe 11. La molecule CD4 se lie a la portion juxtamembranaire des molecules de classe II.
Le rôle respectif des cellules CD4+ et CD8+ dans 1’allodestruction reste debattu. Des les annees SO, pour Brent et Medawar, I’immunite antigreffe s’apparentait a un phenomene d’hypersensibilite retardee (due a des cellules T auxiliaires ou CD4+), alors que tout suggerait un r61e fondamental des cellules T cytotoxiques classiques. L’importance experimentale de la mediation du rejet par hypersensibilite retardee a ete montree par plusieurs groupes. Actuellement, cytotoxicite et hypersensibilite retardee sont les deux mecanismes impliques dans le rejet, chacun etant en fait recrute par la qualite de la cible a reconnaitre, puis a detruire.
L’utilisation d’anticorps monoclonaux murins ami-sous-populations Iymphocytaires a permis de caracteriser sur coupes biopsiques les cellules infiltrant le greffon. Les cellules T representent la sous-population Iymphocytaire la plus abondante, avec un rapport cellules CD8+/CD4+ significativement augmente par rapport aux contr61es, sans aucune difference du nombre de Iymphocytes B et de monocytes- macrophages. L’analyse des cellules infiltrant les greffons est maintenant une technique de routine dans certaines equipes de transplantation.
Role des cellules naturelles tueuses, Iymphocytes NK (natura/ killerl, dans le systeme de cytotoxicite dependante des anticorps ADCC (antibody dependent cellular cytotoxicityl Parmi les Iymphocytes envahissant le greffon tres precocement, les LGL (large granular Iymphocytes), tres proches des Iymphocytes NK, voire identiques, sont en proportion tres abondante. Sur le plan experimental, les LGL ont un pic vers le 4e jour et decroissent ensuite. Les LGL sont aussi presents dans les autogreffes ou la reaction inflammatoire est constituee de Iymphocytes et de monocytes sans cellules Iymphoblastiques. Le r61e des cellules NK est discute [9], d’autant que la fonction NK des Iymphocytes peripheriques augmente au cours du rejet, sans doute secondairement a la secretion d’interféron et d’lL2. Une activite cytotoxique de type ADCC est souvent mise en evidence au sein des cellules du greffon, en testant soit les anticorps peripheriques, soit les anticorps fixes aux structures du greffon, et pourrait etre impliquee dans les mecanismes du rejet.
Role des Iymphocytes B et des macrophages Une proportion non negligeable de Iymphocytes B est generalement mise en evidence au cours du rejet aigu (20 30 p. I OO du total de l’infiltrat) et leur r61e exact reste meconnu. La presence des plasmocytes secretant des immunoglobulines in situ demontre une maturation locale de ces cellules. Des Iymphocytes B contenant des IgG et des IgM peuvent etre mis en evidence tres t6t dans le rejet de greffe renale, mais ils disparaissent rapidement et tres peu finalement secretent des immunoglobulines. La speecificite de ces immunoglobulines reste a determiner, et il pourrait ne s’agir que d’une activation polyclonale faisant suite a une importante activation T.
Le systeme monocytaire-macrophagique represente aussi une portion non negligeable des cellules infiltrant le greffon au stade precoce: IOp.lOO entransplantation experimentale, et dans une etude de Hancock sur des greffes de rein chez l’homme, 38 p. IOO de la population en cas de rejet modere, mais plus de 60 p. 100 en cas de rejet sévère Ce systeme a un r61e important dans la presentation et la reconnaissance des allo- antigenes, la synthese d’ILI, d’lL6 et de TNF, I’amplification de l’inflammation et dans la cytodestruction directe ou indirecte.
Implications des Iymphokines dans le rejet
Les Iymphokines, secretees par certaines sous-populations Iymphocytaires T et monocytaires, ont un r61e majeur dans la reponse allogenique [IO]: I’ILI, I’IL6, I’interferon gamma, le TNF et surtout l’lL2 ont pris une place prepondeerante dans l’initiation de la reponse immune d’allogreffe. L’IL2 a un r61e capital de meediateur soluble relargue par des sous-populations T activees, agissant comme second signal sur les Iymphocytes T cytotoxiques. L’IL2 peut dans certaines conditions restaurer l’alloreactivite. En transplantation renale humaine, une secretion importante d’lL2 est contemporaine des crises de rejet aigu. Chez le rat sous ciclosporine, le rejet est associe a une secretion importante d’lL2, alors que la tolerance est associee a celle d’lL3. L’implication des Iymphokines dans l’induction du rejet, et eventuellement de la tolerance, est renforcee par d’autres arguments indirects: par exemple, I’administration d’anticorps monoclonaux diriges contre la chatne alpha de 55 kDa du recepteur de l’lL2 (antigene TAC) prolonge la survie des allogreffes de c_ur chez les rongeurs.
La technique d’HIS (hybridation in situ) permet d’etudier la production de cytokines par les populations immunitaires infiltrant le greffon et l’importance probable de l’lL6 dans 1’initiation des phenomenes de rejet: I’augmentation de la synthese d’ARNm de l’IL6 est tres importante en cas de rejet aigu, alors que l’ARNm de l’interferon alpha n’est pas detecte; dans des greffons a fonction renale normale, aucun signal correspondant a ces Iymphokines n’est detecte.
Analyse clonale du repertoire des Iymphocytes actives in vivo par les allo-antigenes
L’etude du rejet par les techniques sus-citees est une approche » polyclonale >> de l’ensemble des sous-populations cellulaires associees au rejet, dont certaines ne sont qu’accompagnatrices, voire accessoires. Or, tout phenomene de rejet implique l’idee d’une expansion clonale, et donc specifique, d’un tout petit nombre de cellules T, voire d’une seule cellule T, les autres cellules etant recrutees de fa,con non specifique. La theorie de Burnett predit que tout individu possede un repertoire specifique contre tous les allodeterminants qui peuvent lui etre presentes. En pratique, certaines equipes de recherche, en particulier du centre universitaire de Nantes, ont developpe des clones a partir de cellules infiltrant une allogreffe renale rejetee, « race a une technique de dilution limite des cellules, en obtenant une seule cellule par puits de culture Cette cellule est ensuite stimulee par les cellules du donneur et des facteurs de croissance Iymphocytaire (IL2) permettent sa proliferation. Schematiquement, toutes les cellules ainsi obtenues sont d’origine T (T3+, Tl 1+): la moitiee de phenotype T auxiliaire (T4+), I’autre moisie de phenotype suppresseud cytotoxique (CD8+). Tous les clones CD8+ sont cytotoxiques contre les cellules du donneur. Cette approche de l’analyse clonale des cellules effectrices du rejet permet aussi de demontrer in vivo l’efficacite de ces cellules. Ainsi, I’injection chez la souris de clones de CD8+, diriges contre 1’antigene mineur d’histocompatibilite Epal et restreints par le complexe majeur d’histocompatibilité H-2KK, permet d’entrainer un rejet local de peau, de reconnaitre de fa,con specif fique l’antigene mineur Epal, de ne pas recruter de cellules provenant de l’hôte et d’avoir un effet dose-cependant tout a fait direct.
Analyse du recepteur des Iymphocytes T pour les allo-antigenes
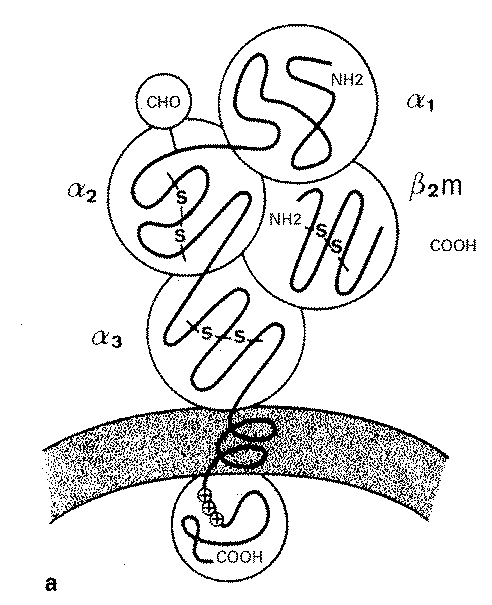
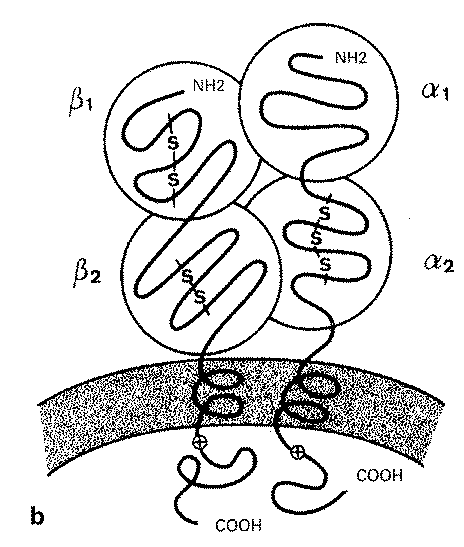
L’utilisation d’anticorps monoclonaux et de clones de cellules T a permis de montrer que le recepteur T est constitue de 2 sou.s-unites fonctionnelles, Ti et CD3, comprenant elles-memes plusieurs sous-unites. Ti alpha et Ti beta pour Ti sont lieees entre elles par un pont disulfure et associees de fa,con non covalente au complexe CD3, lui-meme constitue de plusieurs chames. Dans le systeme de reconnaissance des Iymphocytes T, la molecule CD4 reconnais les molecules d’histocompatibilite de classe 11, la molecule CD8 reconnais telles de classe 1. Puisque le recepteur T est le pivot fondamental de la reconnaissance et de la fonction effectrice Tc dans une reaction de Iyse, spécifique ou non specifique, il est theoriquement possible d’inhiber la reaction de rejet par l’intermediaire d’anticorps diriges contre le recepteur Ti ou contre le récepteur T3. L’inhibition des sous-unites Ti est encore au stade de manipulation in vitro, alors que l’ethcacite des anticorps monoclonaux anti-T3 a ete amplement prouvee en transplantation clinique.
CIBLES DU REJET D’ALLOGREFFE
Les antigenes d’histocompatibilite representent la cible majeure de la reac ion immunitaire. Ce sont principalement les produits des genes du complexe majeur d’histocompatibilité, mais les produits codes par les systemes mineurs, ainsi que certains produits specifiques d’organes (systeme Epa pour la peau, par exemple), peuvent jouer un r61e non negligeable dans certains rejets tardifs. Le r61e d’antigenes << prives >> d’organes n’est pas tres clair, et dans une suite de travaux importants, Hart et Fabre ont montre que 😯 p. IOO des anticorps produits chez le rat apres injection d’homogenat de rein etaient diriges contre les antigenes speecifiques du rein, dont a peu pres la ml itie contre les allo- antigenes specifiques du rein. L’allo-antigene specifique du rein n’etait pas code par un locus du systeme majeur d’histocompatibilite et n’induisait pas de lesion de rejet. Cet antigene etait localise au niveau des membranes basales du tube contourne proximal et a quelques-unes des capsules de Bowman. Des resultats semblables ont ete obtenus par ce groupe dans des systemes d’immunisation de foie et de c_ur En revanche, des antigenes localises au niveau de l’endothelium vasculaire (E) peuvent etre fortement antigeniques et vulnerables lors du rejet d’allogreffe renale. Des anticorps anti-E ont ete detectes dans le serum d’a peu pres 50 p. IOO des malades presentant un rejet irreversible, et ont ete eludes a partir des greffons reje tes. Les antigenes du groupe E sont expnmes sur les monocytes et les granuleux et non sur les Iymphocytes non stimules, sur les plaquettes et les globules rouges. Cet antigene est present sur l’endothélium vasculaire des capillaires peritubulaires, sur les glomerules et les arteres de moyen calibre.
Les antigenes mineurs de transplantation peuvent servir de cibles importantes en transplantation d’organe. Parmi eux, le systeme H-Y a peut- etre un rôle dans le rejet d’allogreffe chez l’homme. Experimentalement, la reponse immunitaire au systeme H-Y est un exemple typique de reponse T importante, qui se manifeste par un rejet d’allogreffe, la generation de cellules I c, une reaction d’hypersensibilité retardee tandis que la reponse humorale est faible. La reponse T inclut differentes sous-populations Iymphocytaires T, dont l’activation est contrôlée par des genes de reponse immune (Ir) localises dans la region K/D ainsi que dans les sous-ragions IA et IE du complexe majeur d’histocompatibilité de la souris; le contr61e pourrait etre assure aussi par des genes Ir non lies au H-2 qui ne sont pas encore definis. De plus, des antigenes de classes I et II sont necessaires pour la reponse, car ils doivent etre associes a l’antigene H-Y pour que celui-ci soit reconnu par les cellules Th et Tc. L’influence deletere du systeme H-Y a ete deemontree en greffe de moelle et de rein chez l’homme.
MODELES D’ETUDE IN VITRO DE LA RÉACTION DE REJET DE L’ALLOGREFFE
Reaction Iymphocytaire mixte (MLR)
C’est un test de reconnaissance des allo-antigenes et de proliferation. Mis en presence et cultives in vitro, les Iymphocytes de deux individus genetiquement differents se transforment et proliferent. Si la proliferation de l’une des deux populations est inhibee par la mitomycine ou l’irradiation, elle est uniquement stimulante. La deuxieme population par contre prolifere. Cette proliferation, quantifiee par l’incorporation de thymidine marquee, est liee a la stimulation par les antigenes d’histocompatibilite de classe II (DR, DP, DQ) de la population stimulante. En cas d’identite a ces loci (jumeaux, individus classe II identiques) aucune proliferation n’apparaît Parmi les Iymphocytes qui proliferent, les Iymphocytes T auxiliaires, T suppresseurs, T cytotoxiques predominent avec secretion de Iymphokines et differenciation de cellules memoires.
Lymphocytotoxicite a mediation cellulaire ICML
Cette reaction met en evidence la phase effectrice de la reponse allogen lue developpee au cours de la CML. Elle permet d’etudier la Iyse specifique de la population repondeuse vis-a-vis de la population stimulante utilisee egalement comme cible de la Iyse. Cette cible est representee par les Iymphocytes, transformes par des mitogenes et marques par un produit radioactif comme le chrome Sl relargue par les cellules detruites. Les antigenes cibles de cette Iyse sont principalement les antigenes d’histocompatibilite de classe I.
CONCLUSION
Il est devenu evident de considerer le rejet d’allogreffe comme eminemment complexe, la notion meme d’alloreactivite ne venant que recemment d’etre mieux comprise, tant par la presentation antigenique par les molecules du CMH (complexe majeur d’histocompatibilite) que par le repertoire du recepteur des Iymphocytes T.
Dans la plupart des circonstances, les Iymphocytes T CD3+ CD4+ et CD3+ CD8+ et les macrophages sont les constituants majeurs de 1’infiltrat cellulaire in situ. Mais cet infiltrat est loin d’etre totalement specifique vis-a-vis de l’histocompatibilite du donneur, car de nombreux mediateurs solubles sont potentiellement secretes localement. Parmi les plus importants, I’ILI, I’IL2, I’IL6, le TNF gamma, I’IL5,…, ont une action de differenciation cellulaire et de proliferation depassant largement le compartiment des cellules immunitaires, specifiques ou non de la reponse allogenique. Des mecanismes immunoregulateurs peuvent contr61er cette reponse allogenique, mais sont encore peu definis in vivo et pourraient etre preferentiellement expandus lors de tentatives d’induction de tolerance specifique. Certains de ces circuits (CD4+, CD8+) peuvent d’ailleurs etre confondus avec les mecanismes du rejet observes in situ.
BIBLIOGRAPHIE
- 1. BENICHOU G, TAKIZAWA PA, oLSON CA et al. Donor major histocompatibility complex (MHC) peptides are presented by recipient MHC molecules during graft rejection. J Exp Med, 1992, 175: 3OS-3O8.
- 2. CHARPENTIER B. Mechanisme of rejection. Transplant Proc, 1983, 15: 259-263.
- 3. KOURILSLKY P. CLAVERIE JM. MHC-antigen interaction: what does the T cell receptor see ? Adv Immunol, 1989, 45: IO7-193.
- 4. LARSEN CP, MORRIS PJ, AUSTYN JM. Migration of dendritic leukocytes from cardiac allograft into host spleens. J Exp Med, 1990, 171: 3()7-314.
- 5. LECHLER Rl, LOMBARDI G. BATCHELOR JR et al. The molecular basis of alloreactivity. Immunoi Today, 199O, 11: 83-88.
- 6. MATIS LA. The molecular basis of T-cell specificity. Ann Rev Immunol, 199(). 8:65-82.
- 7. PANINA-BORDIGNON P, CORRADIN G, ROOSNEK E et al. Recognition by class 11 alloreactive T cells of processed determinants from human serum proteins. Sciences, 1991, 252: IS48-155O.
- 8. PLATT JL, LEBIEN TW, MIC CHAEL AK. Interstitial mononuclear cell population in renal graft rejection. Identification by monoclonal antibodies in tissue sections. J Exp Med, 1982, 155: 17-3O.
- 9. ROTZCHKE o, FALK K. Naturally occuring peptide antigens derived from the MHC class-I restricted processing pathway. Immunol Today, 1991, 12: 447- 455.
- IO. VANDENsRoEKE C, CAILLAT-ZUCMAN S, LEGENDRE C et al. Differential in situ expression of cytokines in renal allograft rejection. Transplantation, 1991, 5/: 6O2-6O9.