- Auteur:S. DEPLUS
- Ouvrage: Traité de Médecine (3ème édition), éd. Flammarion
- Date de publication: septembre 1996
Nous sommes conscients que cet article est relativement ancien; toutefois, il renferme des renseignements qui vous seront sans doute utiles; aussi l’avons-nous laissé en ligne. Par ailleurs, si vous disposiez d’articles plus récents sur le même sujet, n’hésitez pas à nous en faire part afin de demander leur autorisation à leurs auteurs pour une publication en ligne sur ce site
- Rythme de surveillance ophtalmologique
- Complications oculaires liées à la maladie causale
- Complications oculaires liées à la greffe
- Conclusion
De nombreuses complications ophtalmologiques peuvent émailler les années suivant la transplantation d’organe ou la greffe de moelle ; certaines appartiennent en propre à la maladie causale, d’autres sont une conséquence directe du traitement immunosuppresseur ou des réactions du greffon contre l’hôte (GVH). Si ces dernières assombrissent le pronostic vital du patient, la plupart sont heureusement bénéficiaires de thérapeutiques médicales ou chirurgicales, même si elles entravent la réhabilitation du malade. D’emblée, précisons que de nombreuses atteintes du globe oculaire sont asymptomatiques ou paucisymptomatiques, attirant peu l’attention du patient par ailleurs très sollicité. Ainsi, une altération de la membrane sensorielle qu’est la rétine ne se manifeste ni par des douleurs ni par une modification de l’aspect du globe ; ses seuls modes d’expression sont des phénomènes visuels : perception d’éclairs lumineux, de taches, de scotomes et baisse de l’acuité visuelle si la région centrale maculaire est touchée. C’est la raison des bilans ophtalmologiques réguliers dans le suivi d’un greffé.
RYTHME DE SURVEILLANCE OPHTALMOLOGIQUE
L’examen ophtalmologique doit être complet et systématique chez le transplanté : bilan initial avant greffe, afin d’apprécier les manifestations oculaires inhérentes à la maladie causale, et bilans répétés après greffe pour déceler toute complication. Le rythme de ces contrôles est remodelé à la demande à partir du schéma de base : bilan des l00 jours, des 6 mois, des l2 mois puis annuel. Ce sont aussi d’éventuelles manifestations de rejet, des symptomes purement oculaires ou la surveillance des complications elles-mêmes ou encore des données sérologiques qui guident la périodicité des contrôles ophtalmologiques.
Cet examen sera conduit au mieux à la lampe à fente chez un patient assis ; cet appareil permet de tout explorer : segment antérieur, segment postérieur, et d’utiliser des accessoires comme les colorants vitaux, le tonomètre et des lentilles d’examen. Éventuellement, il sera complété par une angiographie de la rétine ou des examens de la fonction visuelle (champ visuel).
COMPLICATIONS OCULAIRES LIEES A LA MALADIE CAUSALE
Dominées par les atteintes rétiniennes (rétinopathie diabétique, hypertensive, leucémique…), elles comptent également des anomalies intégrées dans le tableau initial, en particulier au cours des néphropathies : déformations coniques de la cornée ou du cristallin, dépôts métaboliques cornéens ou cristalliniens, drusens retiniens.
Ces complications et leur retentissement fonctionnel devront être parfaitement appréciées avant la greffe de fa,con à prévoir leur évolution, à pouvoir interpréter de nouveaux éléments et à agir opportunément. Tout d’abord, une situation qui était satisfaisante sur le plan fonctionnel peut ne plus l’être pour des raisons simples : prenons le cas d’un patient porteur d’un kératocône bien équipé en lentilles perméables aux gaz et qui ne tolère plus ses lentilles du fait de l’hospitalisation en chambre stérile. La correction par lunettes ne lui donnera qu’une acuité médiocre et crée un réel handicap. Par ailleurs, ces complications peuvent justifier d’un traitement propre dont la stratégie chronologique est liée aux différents temps de la greffe et nécessite une très étroite collaboration avec l’ophtalmologiste. Par exemple, il faut savoir utiliser les intervalles de temps libre pour programmer une vitrectomie ou une photocoagulation rétinienne en plusieurs séances chez un patient aplasique, maintenu en milieu stérile. Enfin, l’évolution spontanée de ces complications va être perturbée par le protocole de préparation à la greffe et le traitement immunosuppresseur postgreffe. Ainsi la rétinopathie, déjà préoccupante, d’un diabétique dont l’insuffisance rénale a fait poser une indication de greffe reinpancréas, peut s’exacerber brutalement vu le contexte d’instabilité du métabolisme glucidique dans les suites de la greffe.
COMPLICATIONS OCULAIRES LIEES A LA GREFFE
Atteintes toxiques
La chimiothérapie de l’affection causale ou du conditionnement à la greffe peut avoir des conséquences indésirables au niveau oculaire. Nous envisagerons plus loin les altérations de surface pour nous attarder sur la toxicité neuro-rétinienne. Les complications sont souvent bénignes et réversibles : troubles oculomoteurs avec diplopie, ptosis… Plus préoccupantes sont les neurophaties optiques, l’oedème papillaire ou la cécité corticale. Une diminution du contraste, une baisse de vision, une perte de la vision des couleurs sont des symptomes alarmants, pas toujours signalés par un enfant ou un malade fatigué. La radiothérapie et l’administration intracarotidienne des traitements accroissent les risques. Parmi les substances mises en cause, citons le cisplatine, les alcaloïdes de pervenche, les alkylants.
Cataracte
Classique et fréquente, elle est habituellement attribuée à la corticothérapie prolongée. Les corticoïdes au long cours et à doses élevées augmentent les risques d’apparition de ces cataractes et un facteur supplémentaire, le plus souvent associé après greffe de moelle, est l’irradiation corporelle totale. L’observation de ce facteur a fait préférer des irradiations fractionnées et à dose :Paible. kes alkylants comme le busulfan sont cataractogènes. La date d’apparition de la cataracte est retardée par rapport à celle de la greffe et un intervalle de plusieurs années est courant (de l mois à 6 ans après greffe de moelle).
La localisation sur l’axe visuel des opacités cristalliniennes rend compte de la symptomatologie et des divers temps du traitement. L’opacification atteint la capsule postérieure du cristallin de façon tout à fait caractéristique ; l’aspect en mie de pain ou chatoyant des dép6ts est très évocateur. Le patient ressent une baisse d’acuité visuelle, une sensation d’éblouissement, voire une diplopie monoculaire (l’autre oeil étant fermé). 1l n’y a de traitement que chirurgical : la méthode d’extraction du cristallin laisse paradoxalement en place la capsule postérieure porteuse des opacités. Cela explique la fréquente nécessité d’un geste complémentaire ultérieur : l’ouverture de la capsule (au laser YAG le plus souvent). Un implant artificiel autorise une rapide récupération visuelle. Les indications thérapeutiques sont fonctionnelles, compte tenu d’éventuelles lésions associées, la gêne occasionnée par la diminution de l’acuité étant le meilleur argument décisionnel.
Hypertonie oculaire et glaucome chronique à angle ouvert
Quelle différence entre ces deux affections ? Leur tolérance par les fibres du nerf optique. Le rôle de la corticothérapie prolongée est là encore retenu.
Hypertonie oculaire
Elle est asymptomatique et sera dépistée par la prise de la tension au cours de l’examen systématique (normalement comprise entre l0 et 20 mmHg). Son évolution est imprévisible, labile ou permanente. La décision de traiter ou de s’abstenir, sous surveillance, n’est pas facile et sera guidée par des examens répétés. Le traitement repose sur les installations de collyres hypotenseurs surtout représentés par les bêtabloquants : outre la compliance que nécessite la répétition uni ou pluriquotidienne de ces gestes, leurs contre-indications doivent être respectées (asthme, insuffisance cardiaque, troubles de la conduction auriculo-ventriculaire et bradycardie). L’hypertonie peut échapper au traitement médical et se transformer en glaucome si la tolérance de l’hypertonie par le nerf optique diminue et si des signes de soufhance apparaissent.
Glaucome chronique à angle ouvert
Ce passage vers le glaucome se traduit par une réduction progressive du champ visuel, méconnue du patient au début et retrouvée par l’analyse de la sensibilité différentielle, puis par une baisse de l’acuité visuelle portant sur la vision de loin et de près avec évolution à bas bruit vers la perte de la vision périphérique et la cécité par atrophie optique.
Le traitement est d’abord médical : collyres hypotonisants éventuellement complétés par un diurétique, l’acétazolamide. Si la tension oculaire, qui représente le facteur principal à la fois de risque et de possibilité thérapeutique, ne baisse pas, d’autres solutions seront discutées : trabéculo-rétraction au laser qui ouvre des voies d’élimination de l’humeur aqueuse, voire fistulisation chirurgicale ou au laser. Malgré tout, le contrôle de ce type de glaucomes cortisonés reste difficile et préoccupant.
Complications hématologiques
Hémorragies intrarétiniennes
Elles peuvent fuser dans le vitré et poser le problème de leur évacuation.
Thromboses veineuses rétiniennes
Souvent ischémiques, elles menacent la fonction visuelle et font poser l’indication d’une photocoagulation des territoires dévascularisés, évitant la survenue de néovaisseaux iriens ou rétiniens.
Complications infectieuses
L’immunosuppression favorise les infections opportunistes, les surinfections bactériennes ou virales, les métastases septiques au cours d’infections focales ou de septicémies.
Toxoplasmose
La choriorétinite toxoplasmique est une choriorétinite nécrosante due à un protozoaire ubiquitaire, Toxoplasma gondii. L’infestahon peut être congénitale, très souvent latente et alors réactivée par l’immunosuppression, ou beaucoup plus rarement acquise et ne survenant que chez les immunodéprimés. La distinction entre ces deux modalités repose sur la recherche de foyers rétiniens anciens témoins d’une infection congénitale et sur la sérologie qui met en évidence une augmentation des IgM spécifiques dans les atteintes récentes.
Les manifestations cliniques dépendent de la localisation du ou des foyers et de l’importance de la réaction vitréenne associée : myodésopsies, baisse brutale d’acuité visuelle si la macula est concernée, amputation du champ visuel, reflet de l’atteinte des voies visuelles depuis la rétine jusqu’au cortex occipital (une double localisation oculaire et cérébrale est possible). Le foyer frais est de couleur jaune, à bords flous, profond, et accompagné d’un trouble du vitré intense en regard de la lésion et d’une réaction dans la chambre antérieure de l’oeil. Les formes cliniques sont nombreuses : foyer frais isolé ; foyer récent au contact d’une cicatrice pigmentée très évocatrice ; foyers multiples ; foyer maculaire avec une perte définitive de la vision ; réaction vitréenne intense conduisant avec d’autres mécanismes (exsudation, déchirures de la rétine) à une rétraction vitréo-rétinienne et sa conséquence, le décollement de rétine de traitement chirurgical aléatoire ; foyerjuxtapapillaire avec papillite et souvent occlusion vasculaire évoluant pour son propre compte. En cas de doute diagnostique, l’angiographie peut être utile ; la mesure de la charge immunitaire de l’humeur aqueuse est beaucoup moins contributive que chez le sujet immunocompétent.
Le traitement antiparasitaire spécifique et précoce, très efficace, est un test thérapeutique dans certains cas litigieux. Classiquement, il associe pyriméthamine et sulfadiazine : 75 à 100 mg de pyriméthamine, puis 1 mg/kg/j et l00 mg/kg/j de sulfadiazine en surveillant les fonctions rénale et hématologique. En cas d’allergie aux sulfamides, l’association pyriméthamine et clindamycine peut être utilisée. La voie sous-conjonctivale est utilisable pour la clindamycine.
Rétinite à CMV
Le CMV touche particulièrement la rétine, le système nerveux, le tube digestif. C’est souvent pour une positivation de la sérologie ou des prélèvements biologiques que l’on est amené à examiner le fond d’oeil du patient : c’est dire la discrétion fréquente des symptômes ! Les formes cliniques asymptomatiques de la rétinite sont les plus fréquentes. Myodésopsies et brouillard visuel peuvent rester méconnus du malade. Une baisse de l’acuité ou un déficit campimétrique révélant une localisation en rétine parlante, macula ou rétine proche du pôle postérieur, est toujours de pronostic fâcheux. L’atteinte de la papille est souvent compliquée d’occlusions veineuses et compromet gravement le fonctionnement des fibres nerveuses rétiniennes. Le foyer est rétinien, blanc, granuleux, souvent périvasculaire. Fait important : il n’y a pas ou très peu de réaction vitréenne ni antérieure.
Le diagnostic est souvent facile. L’évolution du foyer est caractéristique : extension centrifuge avec un aspect en cocarde, cela sans préjuger d’éventuelles complications. L’intervention chirurgicale d’un décollement de rétine ne donne pas des résultats constants.
Le traitement de la rétinite à CMV, lourd et contraignant, repose sur des virostatiques, le ganciclovir et le foscavir, utilisés par voie systémique et en 2 phases : la première, d’attaque, d’une durée de 3 semaines environ ; la deuxième, d’entretien, posant justement le problème de son interruption, fonction de la tolérance, de la négativité des prélèvements et de l’absence de reprise évolutive de la rétinite. Les effets secondaires et la durée de chaque perfusion, moindres avec le ganciclovir, le font souvent choisir en première intention.
Conjonctivites et kérato-conjonctivites virales
Les conjonctivites et kérato-conjonctivites virales sont dominées par les atteintes du groupe Herpès.
Zona ophtalmique Il survient volontiers sur ce terrain ; la surveillance du globe doit accompagner la durée de l’éruption. La conjonctivite est de type vésiculaire. La kératite est ponctuée, épithéliale ; la forme dendritique peut évoluer vers une kératite stromale, plus difficile à traiter, ou se compliquer d’une uvéite antérieure, volontiers hypertonique. Le traitement repose sur l’aciclovir par voie générale associé, selon le cas, à de la pommade ophtalmique d’aciclovir, à des collyres mydriatiques ou cicatrisants. Le traitement d’une uvéite antérieure est complexe car nécessitant simultanément antiviraux et corticoïdes.
Herpès
Les kératites herpétiques sont douloureuses ; le patient consulte en urgence et on retrouve une ulcération dendritique. Une uvéite antérieure peut compléter le tableau. Le traitement local, basé sur l’utilisation de collyres antiviraux, peut bénéficier d’un débridement mécanique de l’ulcère ainsi que de la prise d’aciclovir.
Conjonctivites bactériennes
Elles ne sont, curieusement, pas plus fréquentes que dans la population générale et sont traitées par antibiothérapie locale adaptée au germe isolé et testé.
Métastases septiques
Parmi les germes rencontrés, on retrouve le staphylocoque, le bacille tuberculeux et des champignons comme Nocardia asteroides, Aspergillus, Fusarium ou Candida albicans. Les foyers ont théoriquement un aspect différent selon le germe mais, de fait, le diagnostic est orienté par le contexte, les hémocultures. Parfois, devant un tableau d’abcès du globe ou un panophtalmie, la biopsie de vitré, voire de liquide sousrétinien, permettra d’établir avec certitude le diagnostic et sera le premier geste thérapeutique (injection intravitréenne).
Sécheresse oculaire
La sécheresse est l’une des complications courantes après greffe de moelle, qu’il faut savoir reconnaitre et éventuellement attribuer à une réaction du greffon contre l’hôte (GVH). Son traitement reste symptomatique et souvent insatisfaisant. Les signes cliniques de la sécheresse sont multiples. L’inconfort est le maître symptôme ; le patient signale une difficulté à ouvrir les yeux le matin, des douleurs brèves le réveillant la nuit ou déclenchées par de nombreux facteurs (fumée de cigarette, vent, froid, lumière vive ou phares, fatigue, effort de lecture…). La photophobie est quasi constante. La sensation de sable, de corps étranger est banale. Un larmoiement paradoxal accompagne souvent cette sécheresse et toute irritation, même minime, fait pleurer le patient. Les yeux sont rouges, sales avec des sécrétions accumulées dans le canthus interne. Le regard est plus terne. À l’examen à la lampe à fente, le film lacrymal moins brillant se déchire trop vite à la chaleur de la lampe (temps de rupture du film diminué). L’examen, douloureux, est facilité par l’installation de collyre anesthésique. Le test de Schirmer ne fait que confirmer l’impression clinique ; l’utilisation des colorants est plus intéressante : la fluorescéine et le rose bengale illustrent les altérations de la surface conjonctivale et cornéenne. L’évolution peut être grave, marquée par des épisodes d’ulcération, de néovascularisation avec opacification de la cornée, voire perforation.
La recherche étiologique est dominée par la crainte d’une GVH ; en effet, devant un tableau associant brûlures, yeux rouges et photophobie, les hypolacrymies iatrogènes (sédatifs, neuroleptiques, antispasmodiques… la liste est longue) sont assez facilement éliminées ; une cause physique est évoquée chez un greffé en bulle stérile dont l’air est très sec ; une conjonctivite allergique s’accompagne volontiers d’une sécheresse, et dans les suites d’une conjonctivite virale le film lacrymal est perturbé ; on n’oubliera pas une cause diététique (amaigrissement, régime dissocié). Enfin, rappelons la toxicité de certaines chimiothérapies, bien connue (cyclophosphamide, méthotrexate, 5 Fu, etc.).
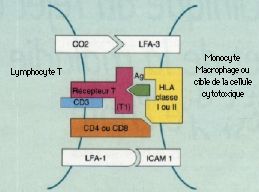
La GVH témoigne d’un conflit immunitaire systémique entre les Iymphocytes incompatibles du donneur et le tissu Iymphoïde du receveur ; les lymphocytes prolifèrent et attaquent des cibles porteuses d’antigènes : ici la peau, les muqueuses et parfois l’uvée. Le choix immunologique du donneur est essentiel dans les greffes de moelle, important dans les transplantations d’organes comme le c_ur, les poumons, le rein, moindre dans les greffes de foie et sans conséquence pour la cornée. Cette notion explique que les patients d’hématologie soient plus menacés et atteints dans 60 à 80 p. l00 des cas. La réaction peut être aiguë ou chronique.
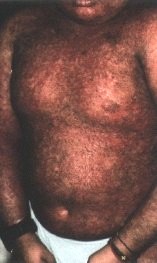
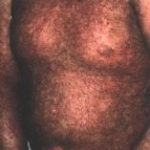
Les signes oculaires de GVH aiguë se déclarent entre la 2e et la 4e semaine après la greffe : blépharite, conjonctivite et kératite. La blépharite n’est que la localisation palpébrale de l’épidermolyse bulleuse. La conjonctivite est de type membraneux avec une desépithélialisation complète de la muqueuse. L’évolution est favorable grâce au traitement général de la GVH et si la membrane se détache spontanément. Mais si elle est arrachée, lors de l’examen ou des soins, le contact direct de la conjonctive bulbaire et du derme tarsal mis à nu favorise leur accolement avec symblépharon et entropion. La destruction des glandes lacrymales accessoires logées dans la conjonctive entraîne une sécheresse. La kératopathie est la conséquence des perturbations du système de protection du globe : simple ponctuation superficielle, bulles épithéliales dont la rupture fait apparaître une plage ulcérée très douloureuse.
Le traitement est celui de la GVH : localement, il faut restaurer un film par des collyres ou pommades cicatrisants et lutter contre l’inflammation par des collyres anti-inflammatoires non stéroïdiens plutôt que par des corticoides.
La GVH chronique débute plus tard, au 3e mois postgreffe, car il s’agit de réactions d’hypersensibilité de type II et III. Les formes cliniques sont nombreuses, mais l’atteinte cutanéo-muqueuse est quasi constante : 90 à l00 p. l00. Le risque est de voir succéder à une phase érythémateuse et lichéniforme une atrophie. La peau est scléreuse et pigmentée ; au niveau de la conjonctive, la muqueuse est décolorée et les glandes lacrymales accessoires détruites. La sécheresse est évidente.
Plus rarement, une uvéite antérieure discrète ou postérieure, à type de vascularite, témoigne du conflit immunitaire. Une myosite des muscles oculomoteurs a été signalée. Le traitement est général, immunosuppresseur. Localement en période érythémateuse, il faut tenter de juguler l’évolution vers une atrophie par un traitement cicatrisant et anti-inflammatoire. Plus tard, un traitement substitutif est proposé : larmes artificielles à la demande, gels d’action plus prolongée, obturation des canaux lacrymaux par des clous. 1l est évident que cet état favorise les surinfections et des complications trophiques de la cornée.
CONCLUSION
La fréquence de ces diverses complications et leur distribution ne sont absolument pas homogènes ; le risque de présenter une complication oculaire au décours d’une greffe est corrélé avec les exigences en matière d’histocompatibilité. Plus elles sont élevées et plus le risque est grand. Par ailleurs les thérapeutiques utilisées pour préparer et réussir la greffe apportent leur propre iatrogénicité.